
【题目】亚氯酸钠(NaClO2)是一种高效漂白剂和强氧化剂。某兴趣小组以NaClO3制取ClO2气体,再由ClO2制得NaClO2,实验装置如下:

回答下列问题:
(1)用NaOH固体配制约20%的NaOH溶液100g,需要的仪器有烧杯、玻璃棒、_____、 _____。
(2)实验须使NaClO3稍微过量,目的是 _____。
(3)为使ClO2气体能被均匀、充分吸收,操作时应注意 _____。
(4)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2—,则另一种为 ___。
(5)B中反应的离子方程式为 ______。
(6)证明NaClO2具有氧化性的方法是:将B中溶液加热除去H2O2,加入 ______ (填序号,下同)酸化,再加入 ______ 检验。
①稀HNO3 ②稀H2SO4 ③K2SO3溶液 ④BaCl2溶液 ⑤FeCl2溶液 ⑥KSCN溶液
(7)装置C的作用是 ______。
【答案】 量筒 天平 使Na2SO3完全反应,避免产生SO2气体 控制硫酸的滴入速度 ClO3- 2ClO2+H2O2+2OH-=2ClO2+2H2O+O2↑ ② ⑤⑥ 防倒吸
【解析】(1)、配制一定质量的溶液需要用到的仪器有:烧杯、玻璃棒、量筒、天平,故答案是:量筒;天平。
(2)、亚硫酸钠和NaClO3均会和硫酸反应,,所以实验时须使NaClO3稍微过量,让亚硫酸钠完全反应,防止亚硫酸钠与硫酸反应产生二氧化硫,故答案为:使Na2SO3完全反应,避免产生SO2气体。
(3)、为使ClO2气体能被均匀、充分吸收,需要控制物质的量以及产生的速率,可以通过控制硫酸的滴入速度来实现,故答案为:控制硫酸的滴入速度。
(4)、NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2-,ClO2-离子中Cl元素的化合价是+3价,ClO2中Cl的化合价是+4价,说明ClO2到ClO2-时,Cl的化合价降低1个价态,根据氧化还原反应中得失电子守恒规律,则ClO2中Cl的化合价也应该升高1个价态到+5价,所以另一种离子应是ClO3-,所以答案是ClO3-。
(5)、ClO2气体在碱性环境下能将H2O2氧化,得到ClO2-,所以B中反应的离子方程式是:2ClO2+H2O2+2OH-=2ClO2+2H2O+O2↑。
(6)、NaClO2具有氧化性,能将Fe2+离子氧化为Fe3+,用KSCN检验Fe3+即可,但是HNO3也具有氧化性,会将Fe2+氧化,所以应用硫酸酸化不能用硝酸酸化,故答案是②;⑤⑥。
(7)、利用装置C可以防止倒吸。


 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
【题目】某化学实验室需要0.2mol/L NaOH溶液500mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是(填序号),配制上述溶液还需用到的玻璃仪器是(填仪器名称). 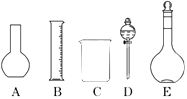
(2)容量瓶是配制溶液的主要仪器,容量瓶上标有以下六项中的(填写序号).
①温度 ②浓度 ③容量 ④压强 ⑤酸式或碱式 ⑥刻度线
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次) .
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约50mL),用玻璃棒慢慢搅动,使其充分溶解,冷却到室温
C.将容量瓶盖紧,摇匀
D.将溶解的氢氧化钠溶液沿玻璃棒注入容量瓶中
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
(4)根据计算,配制0.2mol/L NaOH溶液500mL需 NaOH固体的质量为:g.
(5)配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是: .
(6)将所配制的稀H2SO4进行测定,发现实际浓度小于0.5mol/L.请你分析下列哪些操作会引起所配浓度偏小(填写字母) .
A.用量筒量取浓硫酸时,仰视量筒的刻度
B.容量瓶未干燥即用来配制溶液
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容
D.往容量瓶转移时,有少量液体溅出
E.在容量瓶中定容时俯视容量瓶刻度线
F.烧杯未进行洗涤
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冬天使用的热敷袋里面有铁粉、氯化钠、碳粉,利用铁被氧化放出的热量取暖.某同学拆开一袋后取里面的固体粉末进行实验:
①将粉末投入盛有足量稀盐酸的烧杯中,观察到有大量气泡产生,底部有黑色粉末.则发生反应的离子方程式为 .
②为分离出反应后的溶液,可将上述烧杯中混合物进行操作,该操作需要的玻璃仪器为 .
③在②得到的溶液中通入氯气,发生如下离子反应:2Fe2++Cl2=2Fe3++2Cl─;在该离子方程式中,当有ag氧化产物生成时,需通入标准状况下的氯气体积为L(用含a的代数式表示).
④该同学将少量铜片投入制得的含FeCl3的溶液中,发现铜片慢慢溶解消失,溶液由黄色变为青绿色.则发生反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化亚铜(CuI)是阳极射线管复盖物、也是重要的有机反应催化剂,不溶于水和乙醇。下图是用废铜电缆(杂质中含有少量铁)制取无水碘化亚铜的流程。
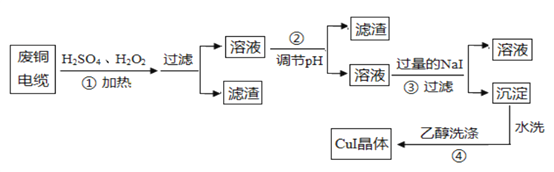
(1)过程①得到的溶液呈蓝色,其原因是_______________________(用化学方程式表示),当温度高于40℃时,反应的速度下降,原因是 _____________________ 。
(2)已知:Cu(OH)2的Ksp=2.2×10-20,Fe(OH)3的Ksp=2.16×10-39,lg6=0.78,过程②中用_____________调节溶液的pH值,
A.NaOH B.NH3·H2O C.CuO D.CuCO3
得到的滤渣成分是 __________ 。
(3)过程③的氧化产物能使淀粉变蓝,对应的离子方程式为 ________________ 。
(4)过程④用乙醇洗涤的目的为 _____________________________ 。
(5)准确称取m gCuI样品,加入足量的Fe2(SO4)3溶液中,写出该该反应的离子方程式____________________________________待样品完全反应后,用a mol/L酸性KMnO4溶液滴定,达到终点时,消耗的体积平均值为Vml,则样品中CuI的质量分数为 ____________ 。
(已知:5Fe2++MnO4- + 8H+ = 5Fe3+ + Mn2+ +4H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液中可能存在Al3+、Fe2+、NH4+、Ba2+、Cl-、CO32-、SO42-、NO3-中的若干种,现取适量溶液进行如下实验:
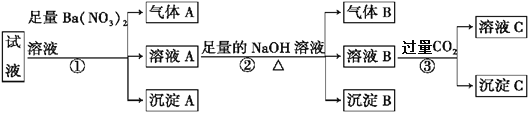
下列有关判断不正确的是
A. 原溶液中一定有Fe2+、SO42-、H+、NH4+、Al3+
B. 原溶液中一定没有Ba2+、CO32-、NO3-
C. 步骤③中反应的离子方程式为2AlO2-+CO2+3H2O2Al(OH)3↓+ CO32-
D. 气体A、B之间能发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:① CO(g)+2H2(g)![]() CH3OH(g) △H 1=-90.7 kJ·mol-1
CH3OH(g) △H 1=-90.7 kJ·mol-1
② 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
③ CO(g)+H2O(g)![]() CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)的△H=______kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H=______kJ·mol-1。
(2)下列措施中,能提高CH3OCH3产率的有__________。
A.使用过量的CO B.升高温度 C.增大压强
(3)将合成气以n(H2)/n(CO)=2通入1 L的反应器中,一定条件下发生反应:
4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是___________。
CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是___________。
A.△H <0
B.若在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%
C. △S<0
D.P1<P2<P3
(4)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚。观察图2回答问题。催化剂中n(Mn)/n(Cu)约为___________时最有利于二甲醚的合成。
(5)图3为绿色电源“二甲醚燃料电池”的工作原理示意图,a电极的电极反应式为__________

(6)甲醇液相脱水法制二甲醚的原理是:CH3OH +H2SO4→CH3HSO4+H2O,CH3 HSO4+CH3OH→CH3OCH3+H2SO4。与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是_________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com