
【题目】X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数表化如下图所示。已知X的一种核素的质量数为18,中子数为10,Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强。

(1)W位于元素周期表中第 周期第 族。画出X的阴离子的结构示意图 。
(2)Z的氢化物和溴化氢相比,较稳定的是 (写化学式);Z的氢化物与氟化氢相比,沸点较高的是 (写化学式)。
(3)Y的金属性与Mg的金属性相比, (写化学式)的金属性强,请用实验证明它们金属性的相对强弱: 。
(4)写出Y的最高价氧化物对应的水化物与Z的最高价氧化物对应的水化物发生反应的化学反应方程式: 。
【答案】(1)三、IVA(各1分)离子结构示意图略(1分)
(2)HCl(1分);HF(1分);
(3)Na(1分)Na与冷水剧烈反应,而Mg与冷水反应较慢(其它合理答案也可)(2分)
(4)NaOH+HClO4=NaClO4+H2O(2分)
【解析】
试题分析: X、Y、W、Z是四种常见的短周期元素,已知X的一种核素的质量数为18,中子数为10,则X元素原子的质子数为18-10=8,故X为氧元素;Y和Ne原子的核外电子数相差1,X为Na或F,X原子半径大于氧原子,故X为Na元素;W的单质是一种常见的半导体材料,原子序数大于Na元素,故W为Si元素;Z的吸引电子的能力在同周期主族元素中最大,原子序数大于Si,故Z为Cl元素。(1)W为Si,原子核外电子数为14,有3个电子层,最外层电子数为4,处于周期表中第三周期IVA族;(2)Z为Cl元素,由于元素的非金属性Cl>Br,故氢化物稳定性HCl>HBr,较稳定的是HCl;由于在HF分子之间存在氢键,增加了分子之间的吸引力,所以物质的熔沸点较高的是HF;(3)同周期随原子序数增大原子半径减小,原子失去电子的能力逐渐减弱,元素的金属性逐渐减弱,所以金属性Na>Mg;元素的金属性越强,其单质与水货酸置换出氢气就越容易。所以可以通过Na与冷水剧烈反应,而Mg与冷水反应较慢证明元素的金属性Na>Mg;(4)Y的最高价氧化物对应的水化物NaOH是强碱,Z的最高价氧化物对应的水化物HClO4是一元强酸,二者发生酸碱中和反应,产生高氯酸钠和水,发生反应的化学反应方程式是NaOH+HClO4=NaClO4+H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】
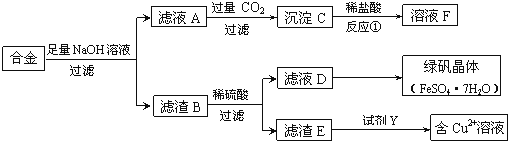
(1)合金与足量氢氧化钠溶液反应的离子方程式是 。
(2)若D中含有Fe3+,除去Fe3+的常用试剂是 。
(3)若要从滤液D中得到绿矾晶体,必须进行的实验操作步骤: 、冷却结晶、过滤、自然干燥。
(4)若由滤渣E得到含Cu2+的溶液,试剂Y可能是 (填选项字母)。
A.稀硝酸 | B.浓硫酸 | C.浓盐酸 | D.稀硫酸 |
根据所选试剂写出一个由滤渣E得到含Cu2+溶液的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海藻中含丰富的、以离子形式存在的碘元素。下图是实验室从海藻里提取碘的流程的一部分:
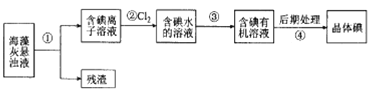
下列判断正确的是( )
A.步骤①、③的操作分别是过滤、萃取分液
B.可用淀粉溶液检验步骤②的反应是否进行完全
C.步骤③中加人的有机溶剂是乙醇
D.步骡④的操作是过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质结构的说法正确的是
A.78 g Na2O2晶体中所含阴、阳离子个数为3NA
B.3.4 g氨气中含有0.6NA个N—H键
C.Na2O2的电子式为:![]()
D.PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的反应原理用离子方程式表示正确的是( )
A. 室温下,测的氯化铵溶液pH<7,证明一水合氨的是弱碱:NH4++2H2O=NH3·H2O+H3O+
B. 用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-+2H2O=2AlO2-+3H2↑
C. 用碳酸氢钠溶液检验水杨酸中的羧基:
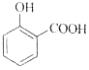 +2HCO3-→
+2HCO3-→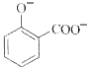 +2H2O+2CO2↑
+2H2O+2CO2↑
D. 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行实验探究:探究碳、硅元素的非金属性的相对强弱。实验装置如下,请根据要求回答下列问题:
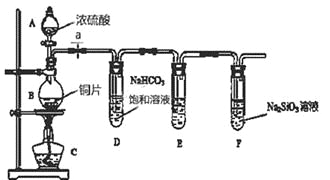
(1)填写所示仪器名称:A 。
(2)实验步骤:连接仪器、 、加药品后,打开a、然后滴入浓硫酸,加热。
(3)问题探究:(已知酸性强弱:亚硫酸 >碳酸)
①铜与浓硫酸反应的化学方程式是 ;装置E中盛足量酸性KMnO4溶液的作用是 。
②该实验证明碳元素的非金属性比硅元素非金属性强的实验依据是 。
③依据试管D中发生的反应,能否证明硫元素的非金属性强于碳元素的非金属性 (填“能”或“否”),原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是( )
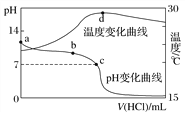
A. a点由水电离出的c(H+)=1.0×10-14 mol·L-1
B. b点:c(NH![]() )+c(NH3·H2O)=c(Cl-)
)+c(NH3·H2O)=c(Cl-)
C. c点:c(Cl-)=c(NH![]() )
)
D. d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第3周期元素的基态原子中,不可能出现d电子,主要依据是
A. 能量守恒原理
B. 泡利不相容原理
C. 洪特规则
D. 近似能级图中的顺序3d轨道能量比4s轨道高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com