
【题目】下列实验的反应原理用离子方程式表示正确的是( )
A. 室温下,测的氯化铵溶液pH<7,证明一水合氨的是弱碱:NH4++2H2O=NH3·H2O+H3O+
B. 用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-+2H2O=2AlO2-+3H2↑
C. 用碳酸氢钠溶液检验水杨酸中的羧基:
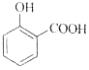 +2HCO3-→
+2HCO3-→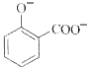 +2H2O+2CO2↑
+2H2O+2CO2↑
D. 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.虽然油脂的相对分子质量都较大,但油脂不属于高分子化合物
B.淀粉和纤维素的化学式均为(C6H10O5)n,二者互为同分异构体
C.酯化反应属于取代反应
D.乙烯使酸性高锰酸钾溶液褪色与乙烯使溴水褪色的原理不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数表化如下图所示。已知X的一种核素的质量数为18,中子数为10,Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强。

(1)W位于元素周期表中第 周期第 族。画出X的阴离子的结构示意图 。
(2)Z的氢化物和溴化氢相比,较稳定的是 (写化学式);Z的氢化物与氟化氢相比,沸点较高的是 (写化学式)。
(3)Y的金属性与Mg的金属性相比, (写化学式)的金属性强,请用实验证明它们金属性的相对强弱: 。
(4)写出Y的最高价氧化物对应的水化物与Z的最高价氧化物对应的水化物发生反应的化学反应方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一无色透明强酸性溶液,可能含K+、NH4+、Al3+、Cu2+、Fe2+、SO42-、SiO32-、CO32-、NO3-等离子中的若干种,现做如下实验:
①取少量该溶液,加入足量用稀硝酸酸化的BaCl2溶液,有白色沉淀生成。
②另取①中上层澄清溶液,加入氢氧化钠溶液,生成沉淀的物质的量随NaOH溶液的体积变化的图象如下所示。
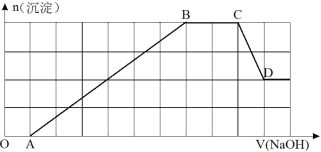
请完成下列问题:
(1)原溶液中一定存在(H+、OH-不必写出)___________,一定不存在________________,可能存在____________。
(2)原溶液中肯定含有的阳离子(H+除外)物质的量之比为________________。
(3)步骤①中若有氧化还原反应请写出对应离子方程式(若无,填写“无”)________________。
(4)若已知步骤②中最终形成1mol沉淀。现取原溶液加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:乙烯可被酸性高锰酸钾溶液氧化为CO2。可以用来除去甲烷中混有的少量乙烯的操作方法是( )
A.将混合气体通过盛有硫酸的洗气瓶
B.将混合气体通过盛有足量溴水的洗气瓶
C.将混合气体通过盛有水的洗气瓶
D.将混合气体通过盛有酸性高锰酸钾的洗气瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
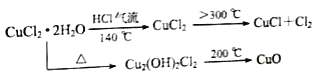
【题目】CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl2·2H2O制备CuCl,并进行相关探究。
【资料查阅】
【实验探究】该小组用下图所示装置进行实验(夹持仪器略)
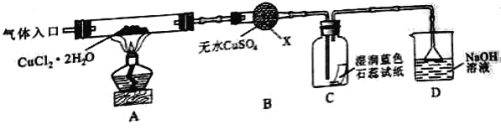
请回答下列问题:
(1)仪器X的名称是____________________.
(2)实验操作的先后顺序是a→_________→__________ → _________→e(填操作的编号)
a.检查装置的气密性后加入药品 b.熄灭酒精灯,冷却
c.在“气体入口”处通入干燥HCl d.点燃酒精灯,加热
e.停止通入HCl,然后通入N2
(3)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是_________________.
(4)装置D中发生的氧化还原反应的离子方程式是____________________.
(5)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析:
①若杂质是CuCl2,则产生的原因是:_________________________.
②若杂质是CuO,则产生的原因是:_________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com