
| 电离能 | I1 | I2 | I3 | I4 | … |
| Im/kJ•mol-1 | 578 | 1817 | 2745 | 11578 | … |
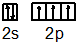 .
.分析 (1)该元素的第四电离能剧增,说明价电子数为3;N原子价电子排布式为2s22p3,结合泡利原理、洪特规则画出价电子排布图;
(2)[Zn(NH3)4]2+中Zn2+与NH3形成4个配位键,属于σ键,NH3分子中含有3个σ键;
(3)向硫酸亚铁溶液中加入几滴K3[Fe(CN)6],会生成Fe3[Fe(CN)6]2蓝色沉淀;
与CN-互为等电子体的微粒有2个原子、价电子总数为10个;
同周期随原子序数增大元素第一电离能呈增大趋势,氮元素原子2p轨道为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的;
孤对电子之间排斥作用>孤对电子与成键电子对之间排斥>成键电子对之间排斥;
(4)金属Fe为体心立方堆积,Fe原子处于晶胞体心与顶点,利用均摊法计算晶胞中Fe原子数目,用阿伏伽德罗常数、摩尔质量表示出晶胞质量,处于体对角线上的Fe原子相邻,若Fe原子半径为a cm,则晶胞体对角线长度为4a cm,则晶胞棱长为$\frac{4a}{\sqrt{3}}$ cm,再根据m=ρV进行计算.
解答 解:(1)该元素的第四电离能剧增,说明价电子数为3,应是Al元素;N原子价电子排布式为2s22p3,结合泡利原理、洪特规则,可知价电子排布图为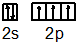 ,
,
故答案为: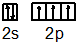 ;
;
(2)[Zn(NH3)4]2+中Zn2+与NH3形成4个配位键,属于σ键,NH3分子中含有3个σ键,1mol[Zn(NH3)4]2+中15molσ键,1mol该离子含有σ键的数目为:15NA,
故答案为:15NA;
(3)向硫酸亚铁溶液中加入几滴K3[Fe(CN)6],会生成Fe3[Fe(CN)6]2蓝色沉淀;
与CN-互为等电子体的微粒有2个原子、价电子总数为10个,为CO、N2等;
同周期随原子序数增大元素第一电离能呈增大趋势,氮元素原子2p轨道为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的,故第一电离能N>O>C;
三种氢化物的VSEPR模型均为四面体形,水分子中含有2对孤对电子,氨气分子含有1对孤对电子,甲烷分子没有孤对电子,孤对电子之间排斥作用>孤对电子与成键电子对之间排斥>成键电子对之间排斥,故键角:CH4>NH3>H2O,
故答案为:产生蓝色沉淀;CO、N2等;N>O>C;CH4>NH3>H2O;
(4)金属Fe为体心立方堆积,Fe原子处于晶胞体心与顶点,晶胞中Fe原子数目为1+8×$\frac{1}{8}$=2,则晶胞质量为2×$\frac{M}{{N}_{A}}$g,处于体对角线上的Fe原子相邻,若Fe原子半径为a cm,则晶胞体对角线长度为4a cm,则晶胞棱长为$\frac{4a}{\sqrt{3}}$ cm,则2×$\frac{M}{{N}_{A}}$g=ρg/cm3×($\frac{4a}{\sqrt{3}}$ cm)3,整理可得M=$\frac{32ρ{a}^{3}{N}_{A}}{3\sqrt{3}}$,
故答案为:$\frac{32ρ{a}^{3}{N}_{A}}{3\sqrt{3}}$.
点评 本题是对物质结构与性质的考查,涉及电离能、核外电子排布、化学键、等电子体、晶胞计算等,注意理解电离能与价电子数关系,同周期第一电离能异常原因,掌握均摊法进行晶胞有关计算.


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
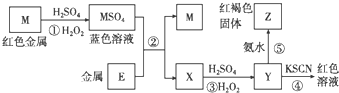
| A. | E2+的氧化性比M2+的氧化性强 | |
| B. | 在③反应中若不加稀硫酸可能看到红褐色沉淀 | |
| C. | 反应④的离子方程式可表示为:E3++3SCN-?E(SCN)3↓ | |
| D. | 在反应①中只能用浓硫酸,既表现了酸性、又表现了氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
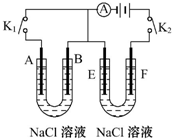 如图所示,A、F为石墨电极,B、E为铁片电极.按要求回答下列问题.
如图所示,A、F为石墨电极,B、E为铁片电极.按要求回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 属于两性氧化物 | B. | 能与氢氧化钠反应 | ||
| C. | 能与硫酸反应 | D. | 常温下能溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽油、柴油和地沟油都是碳氢化合物 | |
| B. | 石油的分馏和煤的干馏都是化学变化 | |
| C. | 苯环内含有碳碳单键和碳碳双键 | |
| D. | 纤维素、淀粉、蛋白质在一定条件下都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | ||
| M |
 ;
;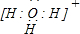 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
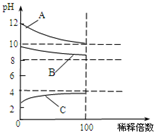 现有常温时浓度相同的五种电解质溶液:①CH3COOH ②Na2CO3 ③HNO3④CH3COONa ⑤NaOH
现有常温时浓度相同的五种电解质溶液:①CH3COOH ②Na2CO3 ③HNO3④CH3COONa ⑤NaOH查看答案和解析>>
科目:高中化学 来源: 题型:解答题
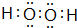
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com