
����Ŀ����������������ˮ����ζ������������ˮ�㾫�����쾫�ͣ�Ҳ��������ʳƷ�У�ʵ�����Ʊ��������£�
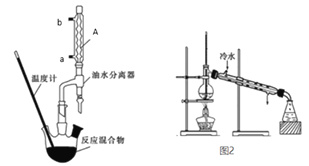
�������������ֲ�Ʒ���Ʊ�
�ڸ����50mL����Բ����ƿ�У�����6.1g�����ᡢ������ˮ�Ҵ���8mL����1mLŨ���ᣬҡ�Ⱥ�ӷ�ʯ����װ��ˮ����ˮԡ���ȣ���ʼ���ƻ����ٶ�1��2d/s����Ӧʱ�����Ҵ���ˮ���γ�����������������������Ȼ���Լ1Сʱ������ˮ���в�����Сˮ������ʱ��ֹͣ���ȡ���Ϊ����װ�ã����������Ҵ��ͱ���
�е㣨���� | ��Է������� | |
������ | 249 | 122 |
���������� | 212.6 | 150 |
��1��д������������18O��ǵ��Ҵ�������Ӧ�ķ���ʽ___________________��
��2������A�����Ƽ���ˮͨ���_________________________��
��3��ͨ����ˮ�����Ϸ����ȥ��Ӧ���ɵ�ˮ��Ŀ����___________________��
��4��ʵ�������û�мӷ�ʯ����д�����ӷ�ʯ�IJ���___________________��
��5��ͼ2װ���еĴ���______________________��
���������������ľ���
�������������ֲ�Ʒ�����·������о��ƣ�����ƿ�е�Һ�嵹��ʢ��30mL��ˮ���ձ��У������·������뱥��Na2CO3��Һ������ϸ�ķ�ĩ�����������������pH��ֽ����²���Һ�����ԡ��÷�Һ©���ֳ��ֲ��ˮ�������ѣ�10mL����ȡ���ϲ��л��࣬����ˮCaCl2��������Ĵֲ�������ˮԡ�������ѣ��ٸ��ü�ѹ�����ռ���֡�
��6�����뱥��̼������Һ���˿��Խ��ͱ����������ܽ���⣬���е�������__________��
��7�����վ�����IJ������У���ò�Ʒ���Ϊ5mL�������������ܶ�Ϊ1.05g��cm3����ʵ��IJ���Ϊ_________��
���𰸡�![]() +CH3CH218OH
+CH3CH218OH![]()
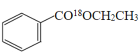 +H2O ���������ܣ�a ʹƽ�����ƣ���߱����������IJ��� ֹͣ���ȣ���Һ����ȴ�ӷ�ʯ �¶ȼ�λ�ã�����ˮ������ ��ȥ������ 70%
+H2O ���������ܣ�a ʹƽ�����ƣ���߱����������IJ��� ֹͣ���ȣ���Һ����ȴ�ӷ�ʯ �¶ȼ�λ�ã�����ˮ������ ��ȥ������ 70%
��������
��ʵ������Ϊ����������Բ����ƿ�й��ȱ����ᡢ�Ҵ�������Ũ����Ļ�����Ӧʱ�����Ҵ���ˮ���γ�����������������������Լ�װ���������ܽ���������������ˮ�����Բ��Ϸ����ˮ��ʹ��Ӧƽ�������ƶ���������ʣ�����ˮ���в�����Сˮ������ʱ��ֹͣ���ȣ�Ȼ������������Ҵ���Ȼ���������б����������ľ��ơ�
(1)�����봼����������Ӧʱ������ȥ�ǻ��������⣬���Է�Ӧ�ķ���ʽΪ![]() +CH3CH218OH
+CH3CH218OH![]()
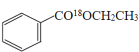 +H2O��
+H2O��
(2)��������A�Ľṹ�ص��֪��Ϊ���������ܣ�Ϊ��ǿ����Ч��Ӧa�ڽ�ˮ��b�ڳ�ˮ��
(3)������ӦΪ���淴Ӧ�����Ϸ����ˮ����ʹƽ�������ƶ�����߱����������IJ��ʣ�
(4)���ӷ�ʯ�IJ���Ϊ��ֹͣ���ȣ���Һ����ȴ�ӷ�ʯ��
(5)����ʱ�¶ȼ�ˮ��������������ƿ֧�ܿڴ���ͼʾ�¶ȼ�λ�ô�������������ˮӦ���¿ڽ���ͼʾ����ˮ�����ڴ���
(6)����̼������Һ���Ժ�δ��Ӧ�ı����ᷴӦ�����Σ��Ӷ���ȥ��Ʒ�еı����
(7)����������ʵ���Ϊ![]() =0.05mol���Ҵ����������ݷ���ʽ��֪�������ɵı���������ӦΪ0.05mol�����Բ���Ϊ
=0.05mol���Ҵ����������ݷ���ʽ��֪�������ɵı���������ӦΪ0.05mol�����Բ���Ϊ![]() =70%��
=70%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£��ֱ�ȡŨ�Ȳ�ͬ�������Ϊ20.00mL��3��HCl��Һ���ֱ����Ũ��Ϊ1.000mol��L-1��0.1000mol��L-1��0.01000mol��L-1��NaOH��Һ�����3����Ӧ��ϵ��pH��V(NaOH)�ı仯��������ͼ����V(NaOH)=20.00mLǰ�����ͻԾ������˵������ȷ����
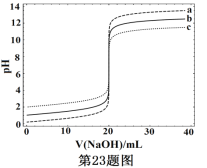
A. 3��HCl��Һ��c(HCl)����������С��100��
B. ����a��b��c��Ӧ��c(NaOH)��a>b>c
C. ��V(NaOH)=20.00mLʱ��3����ϵ�о����㣺c(Na+)=c(Cl-)
D. ��V(NaOH)��ͬʱ��pHͻԾ������ϵ�е�c(H+)���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС����CoCl2��6H2O��NH4Cl��H2O2��Һ�����Ȼ��Ϊԭ�ϣ��ڻ���̿���ºϳ��˳Ȼ�ɫ����X��Ϊ�ⶨ����ɣ���������ʵ�顣
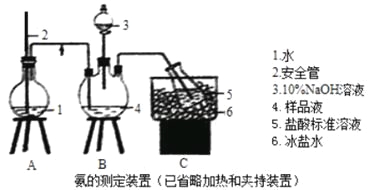
�����IJⶨ����ȷ��ȡwgX��������ˮ�ܽ⣬ע����ͼ��ʾ������ƿ�У�Ȼ����μ�������10%NaOH��Һ��ͨ��ˮ����������Ʒ��Һ�еİ�ȫ����������V1mLc1mol��L��1��������Һ���ա�����������ȡ�½���ƿ����c2mol��L��1NaOH����Һ�ζ���ʣ��HCl�����յ�ʱ����V2mLNaOH��Һ��
���ȵIJⶨ��ȷ��ȡ��ƷX�������Һ����AgNO3����Һ�ζ���K2CrO4��ҺΪָʾ����������ש��ɫ����������ʧΪ�յ㣨Ag2CrO4Ϊש��ɫ����
�ش��������⣺
��1��װ���а�ȫ�ܵ�����ԭ����_________��
��2����NaOH����Һ�ζ���ʣ��HClʱ��Ӧʹ��_____ʽ�ζ��ܣ���ʹ�õ�ָʾ��Ϊ________��
��3����Ʒ�а���������������ʽΪ____________��
��4���ⶨ��ǰӦ�ö�װ�ý��������Լ��飬�������Բ��òⶨ�����___������ƫ��������ƫ��������
��5���ⶨ�ȵĹ����У�ʹ����ɫ�ζ��ܵ�ԭ����___________���ζ��յ�ʱ������Һ��c(Ag��)=2.0��10��5mol��L��1��c(CrO42��)Ϊ______mol��L��1������֪��Ksp(Ag2CrO4)=1.12��10��12��
��6�����ⶨ����ƷX���ܡ������ȵ����ʵ���֮��Ϊ1:6:3���ܵĻ��ϼ�Ϊ______���Ʊ�X�Ļ�ѧ����ʽΪ____________________��X���Ʊ��������¶Ȳ��ܹ��ߵ�ԭ����__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��![]() +CH2=CH-M
+CH2=CH-M![]() -M+HX��XΪ±ԭ�ӣ�MΪ������������ȡ������),���л���A�ϳ�G���㶹�أ��IJ������£�
-M+HX��XΪ±ԭ�ӣ�MΪ������������ȡ������),���л���A�ϳ�G���㶹�أ��IJ������£�
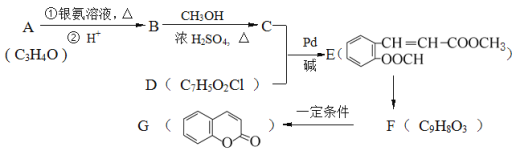
(1)д����ӦC+D��E�ķ�Ӧ���� ___________�� A�й���������Ϊ_________��
(2)д���ṹ��ʽ��B_____________ D______________��
(3)д����Ӧ����ʽ��E��F________��
(4)F�ж���ͬ���칹�壬д��ͬʱ������������������1��ͬ���칹��Ľṹ��ʽ��_______
�ٷ����г������⣬��������״�ṹ
�� �����������ֲ�ͬ��ѧ��������ԭ��
���ܷ���ˮ�ⷴӦ������������Ʒ�Ӧ
����������Cu(OH)2�����ʵ���֮��1��2��Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��ȤС���ͬѧ��չ�˲ⶨNa2CO3��NaCl�Ĺ���������Na2CO3����������̽��ʵ�顣������������µ�ʵ�鷽����

��1��������1����������___________��д����Ӧ�����ӷ���ʽ______________________��
��2���μ�CaCl2��ҺӦ����������������ܻ�ʹ�ⶨ�Ľ��________������ƫ��������ƫС������ȷ��CaCl2��Һ�Ƿ�����ķ�����____________________________��
��3���û������Na2CO3����������Ϊ___________________ ��������λС����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���ѧ�Һ�°�ĸ����Ĵ����������գ�ʹ������Ƚ�������Ϊ��°��Ƽ����������Ϊ��
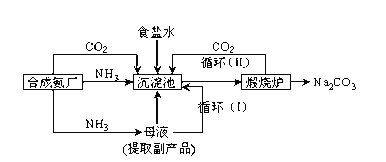
�ٳ������з�Ӧ�Ļ�ѧ����ʽ��______������¯�з����Ļ�ѧ����ʽ��__________
���ڳ����£���Na2CO3����Һ��ͨ��������CO2���о����������˾�����NaHCO3�������þ����ԭ����______________���ڱ��͵�ʳ��ˮ����ͨ�������İ�����ͨ��������CO2������NaHCO3�������������ڱ��͵�ʳ��ˮ����ͨ��������CO2����ͨ�백��������û�о���������ԭ��______��
�ۼ����Ʒ̼�������Ƿ����Ȼ��ƵIJ�������Ϊ��_____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ�������й�������ȷ���ǣ�������
A. l mol OH������������Ϊ10NA
B. 2L0.5 molL��1Na2SO4��Һ�����������������Ϊ0.2NA
C. ��״���£�1.12 L CC14���е���ԭ����Ϊ0.2NA
D. 14 g��CO��N2��ɵĻ�������к��еķ�������ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״���£�����Ϊm������A������Ϊn������B�ķ�������ͬ������˵���в���ȷ���ǣ� ��
A.����A������B����Է���������Ϊm��n
B.ͬ��������A������B�ķ��Ӹ�����Ϊn��m
C.ͬ��ͬѹ�£�A������B������ܶȱ�Ϊn��m
D.��ͬ״���£�ͬ�����A������B�����������Ϊm��n
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵������ȷ����(����)
A.0.2 mol��ԭ���к�1.6NA������
B.1 mol �Ȼ�þ�к���������ΪNA
C.12.4 g�����к�����ԭ����Ϊ0.1NA
D.28 gһ����̼���������ĵ�����Ϊ20NA
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com