
【题目】某蓄电池反应为NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2。
Fe(OH)2+Ni(OH)2。
(1)该蓄电池充电时,发生还原反应的物质是 (填下列字母),放电时生成Fe(OH)2的质量18 g,则外电路中转移的电子数是 。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
(2)为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常把船体与浸在海水里的Zn块相连,或与该蓄电池这样的直流电源的 极(填“正”或“负”)相连。
(3)以该蓄电池做电源,用右图所示装置,在实验室模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示)。 。

(4)精炼铜时,粗铜应与直流电源的 极(填“正”或“负”)相连,精炼过程中,电解质溶液中c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解,甲同学设计如下除杂方案:
![]()
已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
开始沉淀时的pH | 2.3 | 7.5 | 5.6 | 6.2 |
完全沉淀时的pH | 3.9 | 9.7 | 6.4 | 8.0 |
则加入H2O2的目的是 ,乙同学认为应将方案中的pH调节到8,你认为此观点 (填“正确”或“不正确”),理由是 。
【答案】(1)C 0.4NA 或2.408×1023(2)负
(3)Al=Al3++3e- Al3++3HCO3-=Al(OH)3↓+3CO2↑
(4)正 将Fe2+氧化为Fe3+ 不正确 因同时会使Cu2+生成沉淀而除去
【解析】
试题分析:(1)充电时Fe(OH)2得到电子,被还原,发生还原反应,变为Fe。内产生1mol的Fe(OH)2,转移电子2mol,现在产生Fe(OH)2的物质的量为18g÷90g/mol=0.2mol,所以转移电子的物质的量为0.4NA。(2)为防止轮船被腐蚀,应该把轮船的船体与外界电源的负极相连,这样轮船就不会失去电子,从而得到保护。(3)Al作阳极,发生反应:Al-3e-=Al3+;在溶液中发生反应:Al3++3HCO3-=Al(OH)3↓+3CO2↑。因此可看到溶液变浑浊同时冒气泡。(4)精炼铜时,粗铜应与直流电源的正极相连,精铜与直流电源的负极相连,粗铜在的Fe、Zn也逐渐被氧化变为Fe2+、Zn2+,加入H2O2可以把Fe2+氧化为Fe3+,调整溶液的PH至3.9,这时Fe3+完全为Fe(OH)3沉淀,而Cu2+仍然以离子的形式存在于溶液中。乙同学认为应将方案中的pH调节到8,你认为此观点不正确。这是因为PH=8时会使Cu2+生成沉淀而除去。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列反应属于取代反应的是
A.乙醇在铜做催化剂下与氧气反应B.苯在浓硫酸作催化剂下与硝酸反应
C.乙醛在催化剂下与氧气反应D.乙烯使溴的四氯化碳溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物甲和G都在生活中有很多用途,其合成路线如下:

已知:①R1—CHO+R2—CH2—CHO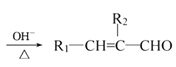 (R1、R2代表烃基或氢原子)
(R1、R2代表烃基或氢原子)
②D与A互为同系物;在相同条件下,D蒸气相对于氢气的密度为39。
(1)A的分子式是____,G中含氧官能团的名称是____。
(2)②的反应类型是____, F的结构简式为______。
(3)B的核磁共振氢谱有____组峰,峰面积之比为_____________。
(4)C有多种同分异构体,其中属于芳香族化合物的有____种。
(5)写出反应①的化学方程式:_____________。
(6)设计实验检验E中的官能团(说明实验操作步骤、现象及结论)____________
(7)G的同分异构体 是一种重要的药物中间体,其合成路线与G相似,请以
是一种重要的药物中间体,其合成路线与G相似,请以![]() 为原料设计它的合成路线(其他所需原料自选,注明反应条件)________。
为原料设计它的合成路线(其他所需原料自选,注明反应条件)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列说法正确的是
A. 0.5mol雄黄(As4S4),结构如右图,含有NA个S-S键![]()
B. 将1molNH4NO3溶于适量稀氨水中,所得溶液呈中性,则溶液中NH4+的数目为NA
C. 标准状况下,33.6L二氯甲烷中含有氯原子的数目为3NA
D. 高温下,16.8gFe与足量水蒸气完全反应,转移的电子数为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图装置中,烧瓶中充满干燥气体a。将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满整个烧瓶。a和b可能是
a(干燥气体) | b(液体) | |
① | NH3 | 水 |
② | CO2 | 饱和NaOH溶液 |
③ | Cl2 | 饱和食盐水 |
④ | NO2 | 水 |
⑤ | HCl | 0.1 mol·L1AgNO3溶液 |
A. ①②③ B. ①②⑤ C. ②④⑤ D. ①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约1:3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液。

已知:Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8℃,42℃以上分解为Cl2和O2。
(1)①实验中控制氯气与空气体积比的方法是_____________________。
②为使反应充分进行,实验中采取的措施有___________________________。
(2)①写出装置B中产生Cl2O的化学方程式:_________________________。
②若B无冷却装置,则进入C中的Cl2O会大量减少。其原因是_____________________。
(3)装置C中采用棕色圆底烧瓶是因为______________________。
(4)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定C中次氯酸溶液的物质的量浓度的实验方案为:用酸式滴定管准确量取20.00 mL次氯酸溶液,________。(可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液。除常用仪器外须使用的仪器有:电子天平,真空干燥箱)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向澄清饱和石灰水中通入二氧化碳,测得溶液导电性(I表示导电能力)的变化,以下与加入物质量的关系正确的是

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )

A. HA为强酸 B. 该混合液pH=7
C. 图中X表示HA,Y表示OH-,Z表示H+ D. 该混合溶液中:c(A—)+ c(Y)=c(Na+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com