
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
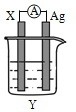
(1)电极X的材料是______;电解质溶液Y是AgNO3,则在银电极上析出______单质;
(2)银电极为电池的______极,发生的电极反应为______;X电极上发生的电极反应为______;
(3)外电路中的电子是从______电极流向______电极(从铜、银中选填)。
【答案】Cu Ag 正 2Ag++2e-=2Ag Cu-2e-=Cu2+ 铜 银
【解析】
(1)原电池中负极失电子发生氧化反应,正极得电子发生还原反应,根据总反应2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s),判断电极材料;(2)原电池中银是正极,电解质中阳离子在正极得电子生成金属单质;铜是负极,负极失电子发生氧化反应;(3)外电路中的电子是从负极流向正极;
解析:(1)根据电池总反应,2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s),铜失电子发生氧化反应,所以铜是负极,X是Cu;Ag+得电子发生还原反应,所以Ag+在正极得电子生成Ag;(2)铜活泼性大于银,银电极为电池的正极,Ag+在正极得电子生成Ag,电极反应为2Ag++2e-=2Ag;Cu在负极失电子发生氧化反应生成Cu2+,Cu电极上发生的反应为Cu-2e-=Cu2+;(3)原电池中电子是从负极流向正极,所以外电路中的电子是从铜电极流向银电极。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】煤和石油不仅是重要的矿物能源,更可以通过综合利用得到多种有机化工产品。煤干馏后可得到焦炭、煤焦油、粗氨水和焦炉气等。焦炭可通过以下途径制取聚氯乙烯等化工产品。
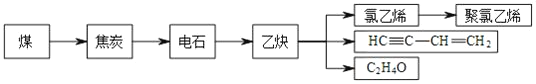
完成下列填空:
(1)石油化工生产乙烯的操作名称为___,实验室制取乙烯的反应条件是___,乙炔的分子空间构型是____,由乙炔生产HC≡C-CH=CH2的基本反应类型是___。在石油生产乙烯的过程中会产生副产品异戊烯,通过催化脱氢法得到异戊二烯,进而的到异戊橡胶,由异戊二烯生产异戊橡胶的化学方程式为:___。
(2)检验C2H4O中是否含有醛基的实验方法是___;其中涉及的化学反应方程式为____。
(3)乙炔可用来合成聚氯乙烯。请以乙烯为原料,无机试剂任选,设计聚氯乙烯的合成路线。____
(合成路线常用的表示方式为:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了探究原电池产生电流的过程,设计了如图所示实验:
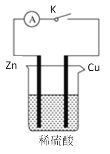
(1)下列叙述中正确的是___。
A.打开开关K时铜片作负极,关闭开关K时铜片作正极
B.打开开关K,锌片和铜片上均有气泡产生
C.关闭开关K后,溶液中的H+浓度减小
D.关闭开关K产生气泡的速率比打开开关K时慢
(2)打开开关K后,装置中发生反应的离子方程式为___。
(3)关闭开关K后,则该装置为___(填“原电池”或“电解池”),锌极为___极(填“正”、“负”、“阳”或“阴”),铜极上的电极反应式为__。若反应过程中有0.3mol的电子发生转移,则产生的气体在标准状况下的体积为___L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是( )
A.CO2是氧化产物
B.H2C2O4在反应中被氧化
C.H2C2O4的氧化性强于ClO2的氧化性
D.ClO2作水处理剂时,利用了其强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图1。由图中可以看出,该同学在操作时的一个错误是___,烧杯的实际质量为____g。
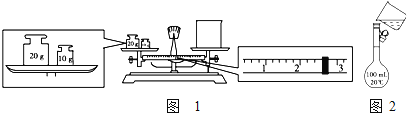
(2)需配制250mL0.2molL-1氯化钠溶液,图2是该同学转移溶液的示意图。指出上面图2中存在的两个错误:①____②____。
(3)用质量分数为98%密度为1.84gcm-3的浓硫酸配制1000mL0.1mol·L-1稀硫酸。
①应用量筒量取浓硫酸____mL。
②配制硫酸溶液时需要用到的仪器有___、____、___、___(除量筒外,写出其余四种)。
③下列操作结果,使所配制溶液物质的量浓度偏高的是____。
A.称量时用了生锈的砝码
B.将NaOH放在纸张上称量
C.定容时俯视刻度线
D.往容量瓶转移时,有少量液体溅出
E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液
H.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素的常见化合价与原子序数的关系图,请回答:
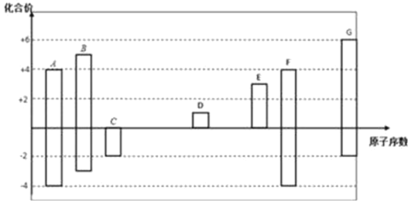
(1)元素F在周期表中的位置是___________________________。
(2)C2﹣、D+、G2﹣离子半径大小顺序是______________(用离子符号回答)。
(3)C和G的氢化物中,沸点较低的是______(填化学式),
因为____________________________________________。
(4)A与C形成化合物AC2的结构式为_______________,D的最高价氧化物的水化物的电子式为___________________。
(5)用电子式表示D与G元素形成化合物的过程______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是一种重要的化工原料,在工农业中都有广泛的应用。
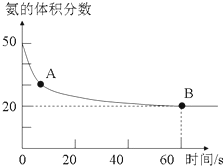
(1)NH3和CO2在120℃和催化剂的作用下可以合成尿素,反应方程式为2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)。某实验小组向一个容积不变的真空密闭容器中充入CO2与NH3合成尿素,在恒定温度下,混合气体中NH3的体积分数随时间的变化关系如图所示(该条件下尿素为固体)。A点的正反应速率v正(CO2)___ (填“大于”“小于”或“等于”)B点的逆反应速率v逆(CO2),NH3的平衡转化率为__。
CO(NH2)2(s)+H2O(g)。某实验小组向一个容积不变的真空密闭容器中充入CO2与NH3合成尿素,在恒定温度下,混合气体中NH3的体积分数随时间的变化关系如图所示(该条件下尿素为固体)。A点的正反应速率v正(CO2)___ (填“大于”“小于”或“等于”)B点的逆反应速率v逆(CO2),NH3的平衡转化率为__。
(2)氨基甲酸铵(NH2COONH4)是合成尿素过程的中间产物,现 将体积比为2∶1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生反应并达到平衡:2NH3(g)+CO2(g)![]() NH2COONH4(s)。实验测得在不同温度下的平衡数据如下表:
NH2COONH4(s)。实验测得在不同温度下的平衡数据如下表:
温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡气体总浓度 (10-3mol·L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.6 |
①上述反应的焓变:ΔH__0,熵变ΔS__0(填“>”“<”或“=”)。
②下列说法能说明上述反应建立化学平衡状态的是_______。
A.混合气体的平均相对分子质量不再发生变化
B.混合气体中NH3与CO2的浓度之比不再发生变化
C.混合气体的密度不再发生变化 D.v正(NH3)=2v逆(CO2)
③根据表中数据,列出25.0℃时该反应的化学平衡常数的计算式K=_____(不要求计算结果),该反应温度每升高10℃,化学平衡常数就变为原来的______倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为短周期元素且原子序数依次増大,质子数之和为40。B、C同周期,A、D同主族,A、C能形成两种液态化合物A2C和A2C2,E的最高价氧化物的水化物呈两性。
(1)B元素在周期表中的位置为_______。
(2)由A、C、D三种元素组成的化合物的电子式为_______。
(3)废印刷电路版上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。現改用A2C2和稀硫酸浸泡既达到了上述目的,又保护了环境,试写出反应的化学方程式______。
(4)若BA3与C2可形成燃料电池,电解质为KOH溶液,则负极的电极反应式为______。(氧化产物不污染环境)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可通过蒸馏石油得到多种沸点范围不同的馏分,装置如图所示。下列说法不正确的是
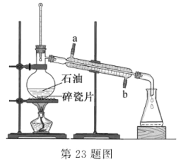
A.沸点较低的汽油比沸点较高的柴油先馏出
B.蒸馏烧瓶中放人沸石可防止蒸馏时发生暴沸
C.冷凝管中的冷凝水应该从 a 口进 b 口出
D.温度计水银球的上限和蒸馏烧瓶支管口下沿相平
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com