
【题目】外围电子排布为3s23p5的元素在周期表中的位置是
A. 第三周期ⅦA族p区 B. 第三周期ⅦB族p区
C. 第三周期ⅦA族s区 D. 第四周期ⅢB族s区
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(NA表示阿伏加德罗常数的值):( )
①28g氮气所含有的原子数目为NA
②4g金属钙变成钙离子时失去的电子数目为0.1NA
③在常温常压下,11.2LN2含有的分子数为0.5NA
④在标准状况下,1mol氦气含有的原子数为NA
⑤常温常压下,32g氧气和32g臭氧都含有2NA个氧原子
⑥标准状况下,1L水所含分子数为1/22.4NA
⑦17g氨气所含电子数目为10NA
A.①②⑤⑥⑦ B.①②④⑤⑥ C.⑤⑦ D.④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学---选修3:物质结构和性质)锂—磷酸氧铜电池正极的的活性物质是Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+4CuSO4+2NH3·H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu2+的核外电子排布式:____________,与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有___________(填元素符号),上述方程式中涉及到的N、O元素第一电离能由小到大的顺序为________________。
(2)PO43-的空间构型是___________。
(3)与NH3具有相同空间构型和键合形成的分子或离子有_________、___________(各举一例)
(4)氨基乙酸铜的分子结构如图,氮原子的杂化方式为______________。

(5)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1molCN-中含有的π键的数目为___________。
(6)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图所示。则该化合物的化学式
为______________________。
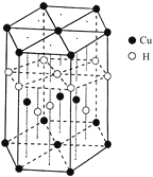
(7)铜晶体为面心立方最密堆积,铜的原子半径为127.8pm,列出晶体铜的密度表达式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据价层电子对互斥理论及原子的杂化理论判断NF3分子的空间构型和中心原子的杂化方式为
A.直线形 sp杂化 B.三角形 sp2杂化
C.三角锥形 sp2杂化 D.三角锥形 sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于反应Zn+ 2HNO3+ NH4NO3→ N2↑+ 3H2O+ Zn(NO3)2,下列判断正确的是
A.生成1 mol N2,电子转移总数为3NA B.生成1 mol N2,电子转移总数为5NA
C.溶解1 mol Zn,电子转移总数为2NA D.溶解1 mol Zn,电子转移总数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol H2(g)和2 mol I2(g)置于某2 L密闭容器中,在一定温度下发生反应:H2(g)+I2(g)![]() 2HI(g)ΔH<0,并达到平衡,HI的体积分数w(HI)随时间(t)变化如图(Ⅱ)所 示。若改变反应条件,w(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是
2HI(g)ΔH<0,并达到平衡,HI的体积分数w(HI)随时间(t)变化如图(Ⅱ)所 示。若改变反应条件,w(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是

A. 恒温恒容条件下,加入适当催化剂
B. 恒温条件下,缩小反应容器体积
C. 恒容条件下,升高温度
D. 恒温条件下,扩大反应容器体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在铜的催化作用下氨气与氟气反应,得到一种三角锥形分子M和一种铵盐N。下列有关说法错误的是
A.该反应的化学方程式为4NH3+3F2→ NF3+3NH4F
B.M是极性分子,其还原性比NH3强
C.M既是氧化产物,又是还原产物
D.N中既含有离子键,又含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水玻璃在工业生产上具有重要的用途,在建筑等行业应用非常广泛。下列不是水玻璃用途的是( )
A.肥皂填料 B.木材防火剂 C.纸板黏合剂 D.制玻璃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com