
【题目】N2(g)与H2(g)在铁催化剂表面经历如图所示过程生成NH3,下列说法正确的是
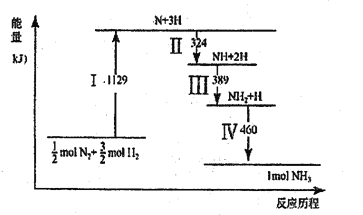
A. Ⅰ中破坏的均为极性键
B. Ⅱ、Ⅲ、Ⅳ均为放热过程
C. Ⅳ中NH2与H2生成NH3
D. N2(g)+3H2(g) ![]() 2NH3(g)ΔH>0
2NH3(g)ΔH>0
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水中有机物可用C6H10O5,表示,咸水中的主要溶质为NaCl。下列有关说法正确的是

A. a为原电池的负极
B. b电极附近溶液的pH减小
C. a电极反应式为![]()
D. 中间室:Na+移向左室,Cl-移向右室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢材在社会发展中应用广泛。为研究某种碳索钢(含少量碳和硫)的成分,科研小组进行了如下探究活动。
称取碳素钢(已除表面氧化物)24.0g放入耐高温反应管中与O2反应,除去未反应的O2,收集到干燥混合气体X 1.12L(已折算成标准状况下的体积)。
(1)科研小组用下图所示实验装置检验混合气体X的组成。

①装置B中的试剂是___________,装置C的作用是_________。
②若观察到________(填实验现象),证明X中含有CO。
(2)反应后,耐高温反应管内固体中除含有Fe3+之外,还可能含有Fe2+。要确定其中的Fe2+,可选用_______(填序号)。
a.KSCN溶液和氯水 b.KSCN溶液和铁粉
c.稀盐酸和K3[Fe(CN)6]溶液 d.稀H2SO4和KMnO4溶液
(3)科研小组用下图所示装置(部分)测定SO2的体积分数,并计算碳素钢的含碳量。将气体X缓慢通过实验装置,当观察到_____(填实验现象)时,停止通气,此时气体流量仪显示的流量为112mL(已换算成标准状况)。则气体X中SO2的体积分数为_____,碳素钢中碳元素的质量分数为_________(保留1位小数)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiAlH4是金属储氢材料,遇水剧烈反应释放出H2,LiAlH4在125℃时分解为LiH、H2和Al。下列说法正确的是( )
A.LiAlH4中Al的化合价为-5价
B.LiAlH4与水反应时,LiAlH4作还原剂
C.LiAlH4在125℃时完全分解,每生成2mol H2,转移电子数2NA个
D.LiH是反应的还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为二氧化锰的有关转化关系图,下列有关说法中不正确的是( )
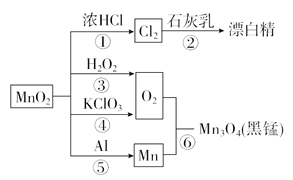
A. 反应①~⑥均属于氧化还原反应
B. 反应⑤中氧化剂与还原剂的物质的量之比为3∶4
C. 相同条件下生成等量的O2,反应③和④转移的电子数之比为1∶1
D. 反应①生成的Cl2经干燥后,可用钢瓶贮运
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中的颜色变化,与氧化还原反应无关的是
A | B | C | D | |
实验 | 新制氯水滴入Na2S 溶液中 | 乙醇滴入K2Cr2O7酸性溶液中 | 饱和FeCl3溶液滴入沸水中 | 草酸滴入KMnO4 酸性溶液中 |
现象 | 产生黄色浑浊 | 溶液由橙色变为绿色 | 液体变为红褐色且澄清透明 | 产生无色气体,溶液紫红色褪去 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组探究铝片做电极材料时的原电池反应,实验如下:
① | ② | ③ |
|
|
煮沸冷却后的溶液 |
电流计指针向右偏转,镁片、铝片表面产生无色气泡 | 电流计指针迅速向右偏转,逐渐向零刻度恢复,经零刻度后继续向左偏转;镁片表面开始时无明显现象,一段时间后有少量气泡逸出;铝片表面持续有气泡逸出。 | 电流计指针向左偏转。铝片表面有气泡逸出,铜片没有明显现象;约3分钟后,铜片表面有少量气泡产生,铝片表面气泡略有减少。 |
下列说法不正确的是
A. 实验①中,镁片做原电池的负极
B. 实验②中,初始时的实验现象对应的原电池反应为:2Mg + O2 + 2H2O ![]() 2Mg( OH) 2
2Mg( OH) 2
C. 实验②中,一段时间后,铝片发生的电极反应式为:Al - 3 e - ![]() Al 3+
Al 3+
D. 实验① ~ ③可推知,铝片做电极材料时的原电池反应与另一个电极的电极材料、溶液的酸碱性、溶液中溶解的O2等因素有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答下列问题。
2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答下列问题。

(1)A是铅蓄电池的___________极,铅蓄电池正极反应式为___________,放电过程中电解液的密度___________ (填“减小”、“增大”或“不变”)。
(2)Ag电极的电极反应式是___________,该电极的电极产物共____________g。
(3)Cu电极的电极反应式是____________,CuSO4溶液的浓度____________(填“减小”、“增大”或“不变”)
(4)如图表示电解进行过程中某个量(纵坐标x)随时间的变化曲线,则x表示___________。

a.各U形管中产生的气体的体积
b.各U形管中阳极质量的减少量
c.各U形管中阴极质量的增加量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳循环”引起各国的高度重视,而如何降低大气中![]() 的含量及有效地开发利用
的含量及有效地开发利用![]() ,引起了全世界的普遍重视。将
,引起了全世界的普遍重视。将![]() 转化为甲醇:CO2(g)+3H2(g)
转化为甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),此研究对
CH3OH(g)+H2O(g),此研究对![]() 的深度开发应用和构建生态文明社会具有重要的意义。
的深度开发应用和构建生态文明社会具有重要的意义。
(1)在一恒温恒容密闭容器中充入1 mol ![]() 和3 mol
和3 mol ![]() 进行上述反应。测得
进行上述反应。测得![]() (g)和
(g)和![]() (g)浓度随时间变化如图所示。
(g)浓度随时间变化如图所示。

①0—10 min内,氢气的平均反应速率为____________,第10min后,保持温度不变,向该密闭容器中再充入2 mol![]() (g)和2mol
(g)和2mol ![]() (g),则平衡______________(填“正向”“逆向”或“不”)移动。
(g),则平衡______________(填“正向”“逆向”或“不”)移动。
②一定温度下,若此反应在恒压容器中进行,能判断该反应达到化学平衡状态的依据是_______。
a.容器中压强不变 b.![]() 的体积分数不变 c.c(
的体积分数不变 c.c(![]() )=3c(
)=3c(![]() )
)
d.容器中密度不变 e.2个C=O断裂的同时有3个H-H断裂
(2)若已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) ![]()
2H2(g)+O2(g)=2H2O(g) ![]()
![]()
![]()
![]()
![]()
则表示![]() (l)燃烧热的热化学方程式为_______________________________。
(l)燃烧热的热化学方程式为_______________________________。
(3)如图,25℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电源电解600 mL 一定浓度的NaCl溶液。

①U形管内发生的化学反应方程式为__________________________________。
②在电解一段时间后,NaCl溶液的pH变为12(假设电解前后NaCl溶液的体积不变),则理论上消耗甲醇的物质的量为____________mol。若向U形管内电解后的溶液中通入![]() 气体,使所得溶液c(
气体,使所得溶液c(![]() ):c(
):c(![]() )=2:1,则此时溶液中的c(
)=2:1,则此时溶液中的c(![]() )= ________________
)= ________________![]() 。(室温下,H2CO3的
。(室温下,H2CO3的![]() ;
;![]() )。
)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com