
【题目】“低碳循环”引起各国的高度重视,而如何降低大气中![]() 的含量及有效地开发利用
的含量及有效地开发利用![]() ,引起了全世界的普遍重视。将
,引起了全世界的普遍重视。将![]() 转化为甲醇:CO2(g)+3H2(g)
转化为甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),此研究对
CH3OH(g)+H2O(g),此研究对![]() 的深度开发应用和构建生态文明社会具有重要的意义。
的深度开发应用和构建生态文明社会具有重要的意义。
(1)在一恒温恒容密闭容器中充入1 mol ![]() 和3 mol
和3 mol ![]() 进行上述反应。测得
进行上述反应。测得![]() (g)和
(g)和![]() (g)浓度随时间变化如图所示。
(g)浓度随时间变化如图所示。

①0—10 min内,氢气的平均反应速率为____________,第10min后,保持温度不变,向该密闭容器中再充入2 mol![]() (g)和2mol
(g)和2mol ![]() (g),则平衡______________(填“正向”“逆向”或“不”)移动。
(g),则平衡______________(填“正向”“逆向”或“不”)移动。
②一定温度下,若此反应在恒压容器中进行,能判断该反应达到化学平衡状态的依据是_______。
a.容器中压强不变 b.![]() 的体积分数不变 c.c(
的体积分数不变 c.c(![]() )=3c(
)=3c(![]() )
)
d.容器中密度不变 e.2个C=O断裂的同时有3个H-H断裂
(2)若已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) ![]()
2H2(g)+O2(g)=2H2O(g) ![]()
![]()
![]()
![]()
![]()
则表示![]() (l)燃烧热的热化学方程式为_______________________________。
(l)燃烧热的热化学方程式为_______________________________。
(3)如图,25℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电源电解600 mL 一定浓度的NaCl溶液。

①U形管内发生的化学反应方程式为__________________________________。
②在电解一段时间后,NaCl溶液的pH变为12(假设电解前后NaCl溶液的体积不变),则理论上消耗甲醇的物质的量为____________mol。若向U形管内电解后的溶液中通入![]() 气体,使所得溶液c(
气体,使所得溶液c(![]() ):c(
):c(![]() )=2:1,则此时溶液中的c(
)=2:1,则此时溶液中的c(![]() )= ________________
)= ________________![]() 。(室温下,H2CO3的
。(室温下,H2CO3的![]() ;
;![]() )。
)。
【答案】0.225 mol/(L![]() min) 正向 bd
min) 正向 bd ![]()
![]() 2NaCl+2H2O
2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑ 0.001
2NaOH+Cl2↑+H2↑ 0.001 ![]()
【解析】
(1)根据![]() =
=![]() ,计算甲醇的反应速率,反应速率之比等于化学方程式计量数之比计算氢气的反应速率,化学平衡常数为生成物浓度幂之比与反应物浓度幂之积的比进而求得化学平衡常数,计算再充入2 mol
,计算甲醇的反应速率,反应速率之比等于化学方程式计量数之比计算氢气的反应速率,化学平衡常数为生成物浓度幂之比与反应物浓度幂之积的比进而求得化学平衡常数,计算再充入2 mol![]() (g)和2mol
(g)和2mol ![]() (g)的浓度商和平衡常数比较判断反应进行的方向;可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的一系列物理量不变,据此分析解答;
(g)的浓度商和平衡常数比较判断反应进行的方向;可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的一系列物理量不变,据此分析解答;
(2)根据盖斯定律计算写出热化学方程式;
(3)惰性电极电解氯化钠溶液生成氢氧化钠、氢气和氯气,以此书写化学方程式;NaCl溶液的pH值变为12,即可求出电解池中放电的H+的物质的量为0.006mol,即电解池的阴极得0.006mol电子,根据流经四个电极的电量相等,从而得出消耗甲醇的量;向U形管内电解后的溶液中通入CO2气体,CO2与NaOH反应生成Na2CO3和NaHCO3,当c(![]() -):c(
-):c(![]() )=2:1时,Ka2=
)=2:1时,Ka2=![]() =
=![]() c(H+),据此计算。
c(H+),据此计算。
(1)图象分析可以知道,甲醇变化浓度为0.75mol/L,甲醇的反应速率![]() (CH3OH)=
(CH3OH)=![]() =0.075mol/(L
=0.075mol/(L![]() min),反应速率之比等于化学方程式计量数之比,
min),反应速率之比等于化学方程式计量数之比,![]() (H2)=3
(H2)=3![]() (CH3OH)=3
(CH3OH)=3![]() 0.075mol/(L
0.075mol/(L![]() min)=0.225 mol/(L
min)=0.225 mol/(L![]() min),结合化学三行计算得到,图象分析可以知道体积为1L,
min),结合化学三行计算得到,图象分析可以知道体积为1L,
CO2(g)+3H![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始量(mol/L) 1 3 0 0
变化量(mol/L) 0.75 2.25 0.75 0.75
平衡量(mol/L) 0.25 0.75 0.75 0.75
该温度下平衡常数K=![]() =5.3,
=5.3,
第10min后,保持温度不变,向该密闭容器中再充入2 mol![]() (g)和2mol
(g)和2mol ![]() (g),
(g),
Qc=![]() =2.2<K=5.3,反应正向进行,
=2.2<K=5.3,反应正向进行,
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) 反应是气体体积减小的反应,恒温恒压密闭容器中,该反应达平衡状态时,正逆反应速率相同。
CH3OH(g)+H2O(g) 反应是气体体积减小的反应,恒温恒压密闭容器中,该反应达平衡状态时,正逆反应速率相同。
a.反应为恒温恒压,压强始终不变,所以容器中压强不变,不能说明反应达到平衡状态,故a错误;
b.![]() 的体积分数不变,能说明反应达到平衡状态,所以b选项是正确的;
的体积分数不变,能说明反应达到平衡状态,所以b选项是正确的;
c. 甲醇和氢气浓度浓度和起始量变化量有关,c(![]() )=3c(
)=3c(![]() )不能说明反应达到平衡状态,故c错误;
)不能说明反应达到平衡状态,故c错误;
d. 反应前后气体质量相同,恒温恒压密闭容器中混合气体的密度不变,能说明反应达到平衡状态,所以d选项是正确的;
e.2个C=O断裂的必然有3个H-H断裂,二者都表示正反应速率,不能说明反应达到平衡状态,故e错误。
因此,本题正确答案是:0.225 mol/(L![]() min),正向,bd;
min),正向,bd;
(2)已知:① CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) ![]()
②2H2(g)+O2(g)=2H2O(g) ![]()
③H2O(g)= H2O(l) ![]()
④CH3OH(g)= CH3OH(l) ![]()
根据盖斯定律②![]() +③
+③![]() 2-①-④得
2-①-④得![]()
![]() ,
,
因此,本题正确答案是:![]()
![]() ;
;
(3) ①用惰性电极电解氯化钠溶液,化学反应方程式为2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑;
2NaOH+Cl2↑+H2↑;
NaCl溶液的pH值变为12,即得出![]() n(OH-)=10-2mol/L
n(OH-)=10-2mol/L![]() 0.6L=0.006mol,根据电解池中阴极的电极反应2H++2e-=H2↑可以知道:电解池的阴极得0.006mol电子。而流经四个电极的电量相等,根据燃料电池的负极反应CH3OH-6e-+H2O=CO2+6H+可以知道CH3OH~6e-,故失0.006mol电子时消耗0.001mol甲醇。
0.6L=0.006mol,根据电解池中阴极的电极反应2H++2e-=H2↑可以知道:电解池的阴极得0.006mol电子。而流经四个电极的电量相等,根据燃料电池的负极反应CH3OH-6e-+H2O=CO2+6H+可以知道CH3OH~6e-,故失0.006mol电子时消耗0.001mol甲醇。
向U形管内电解后的溶液中通入CO2气体,CO2与NaOH反应生成Na2CO3和NaHCO3,当c(![]() ):c(
):c(![]() )=2:1时,Ka2=
)=2:1时,Ka2=![]() =
=![]() c(H+),则此时溶液中的c(
c(H+),则此时溶液中的c(![]() )= 2Ka2=2
)= 2Ka2=2![]() 5
5![]() 10-11=10-10
10-11=10-10![]() 。
。
因此,本题正确答案是:2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑;0.001;10-10。
2NaOH+Cl2↑+H2↑;0.001;10-10。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】N2(g)与H2(g)在铁催化剂表面经历如图所示过程生成NH3,下列说法正确的是
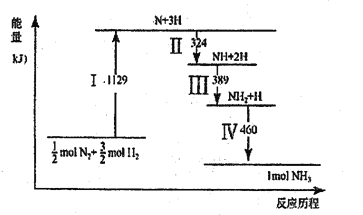
A. Ⅰ中破坏的均为极性键
B. Ⅱ、Ⅲ、Ⅳ均为放热过程
C. Ⅳ中NH2与H2生成NH3
D. N2(g)+3H2(g) ![]() 2NH3(g)ΔH>0
2NH3(g)ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应N2+3H2![]() 2NH3(正反应是放热反应)达到平衡,当单独改变下列条件后,有关叙述错误的是( )
2NH3(正反应是放热反应)达到平衡,当单独改变下列条件后,有关叙述错误的是( )
A. 加催化剂,v正、v逆都发生变化,且变化的倍数相等
B. 加压,v正、v逆都增大,且v正增大的倍数大于v逆增大的倍数
C. 降温,v正、v逆减小,且v正减小的倍数大于v逆减小的倍数
D. 体积不变,加入氩气,v正、v逆都保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳九芳烃是一种混合物,异丙苯就是其中的一种。工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下。下列有关说法正确的是
![]()
A. a的同分异构体有7种B. a能发生取代反应、加成反应和氧化反应
C. b的分子式为![]() D. b、c互为同系物
D. b、c互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学要在奥运五连环中填入物质,使相连物质间能发生反应,不相连物质间不能发生反应。你认为“五连环”中有空缺的一环应填入的物质是( )

A. 硫酸 B. 氧气 C. 二氧化碳 D. 氧化钙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组拟合成染料X和医药中间体Y。

已知:

回答下列问题:
(1)A的系统命名为________________。
(2)C的结构简式为 ____________。
(3)B到C的反应类型是________________。
(4)C+D→E的化学反应方程式为________ 。
(5)F的分子式为____________。
(6)G与A互为同分异构体,请写出满足下列条件的任意两种G的结构简式______________。
①核磁共振氢谱显示G分子中有4个吸收峰;
②红外光谱显示G分子中含有苯环、甲氧基(![]() ),没有羟基、过氧键(-O-O-)
),没有羟基、过氧键(-O-O-)
(7)设计以![]() 和
和![]() 为原料制备Y(
为原料制备Y( )的合成路线(用流程图表示,无机试剂任选)_______________________________________________________。
)的合成路线(用流程图表示,无机试剂任选)_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应H2(g)+ I2(g)![]() 2HI(g),1 mol H2完全反应放出a kJ的热量,依据下表数据,以下说法错误的是( )
2HI(g),1 mol H2完全反应放出a kJ的热量,依据下表数据,以下说法错误的是( )
化 学 键 | H—H | I—I |
断开1 mol化学键时吸收的能量(kJ) | b | c |
A.该反应中反应物的总能量高于生成物的总能量
B.断开1 mol H-H 键和1 mol I-I 键所需能量大于断开2 mol H-I 键所需能量
C.断开2 mol H-I键所需能量为(a+b+c)kJ
D.向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酒精灯加热下列溶液,蒸干后灼烧,所得固体质量最大的是( )
A. 20 mL 2 mol/L FeCl3溶液 B. 40 mL 1 mol/L NaHCO3溶液
C. 20 mL 1 mol/L Na2SO3溶液 D. 40 mL 2 mol/L NH4HCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1L0.1mol/L的 NaHSO4溶液中所含的氧原子数目为0.4NA
B. 1mol-OH(羟基)与1 mol H3O+中所含的电子数均为10NA
C. 7.1gCl2与足量Fe充分反应,转移的电子数为0.2NA
D. 80gCuO和Cu2S的混合物中,所含铜原子数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com