
| A、向AlCl3溶液中滴加过量的氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| B、CaCO3与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O |
| C、小苏打治疗胃酸过多:CO32-+2H+=CO2↑+2H2O |
| D、Cu片与浓硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O |


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、氮气的电子式: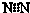 | ||
B、羟基的电子式: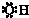 | ||
C、氯离子的结构示意图: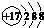 | ||
D、质子数为92、中子数为146的铀(U)原子的核素符号:
|
查看答案和解析>>
科目:高中化学 来源: 题型:
78 34 |
80 34 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
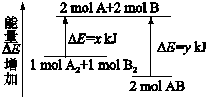
| A、该反应是吸热反应 |
| B、断裂2 mol A-B键需要吸收y kJ的能量 |
| C、2 mol AB的总能量高于1 mol A2和1 mol B2的总能量 |
| D、断裂1 mol A-A键和1 mol B-B键能放出x kJ的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、H2O(g)=H2(g)+
| ||
| B、2H2O(l)=2H2(g)+O2(g)△H=+571.6 kJ?mol-1 | ||
C、H2(g)+
| ||
| D、2H2(g)+O2=2H2O(g)△H=-483.6 kJ?mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com