
【题目】(I)目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO![]() 2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
【资料查阅】①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
(1)完成以下实验设计表(表中不要留空格)。

【图像分析与结论】利用气体传感器测定了三组实验中CO浓度随时间变化的曲线图,如下:
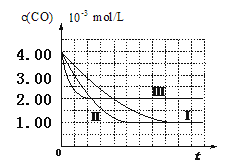
(2)计算第Ⅰ组实验中,达平衡时NO的浓度为__________________; NO 的转化率为
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率_____________(填“增大”、“减小”、“无影响”)。
(II)随着世界粮食需求量的增长,农业对化学肥料的需求量越来越大,其中氮肥是需求量最大的一种化肥。而氨的合成为氮肥的生产工业奠定了基础,其原理为:N2+3H2![]() 2NH3
2NH3
(1)在N2+3H2![]() 2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为 ;
2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为 ;
A.2 s B.3 s C.4 s D.6 s
(2)下列4个数据是在不同条件下测得的合成氨反应的速率,其中反应最快的是 ;
A.v(H2)=0.1 mol·L-1·min-1 B.v(N2)=0.1 mol·L-1·min-1
C.v(NH3)=0.15 mol·L-1·min-1 D.v(N2)=0.002mol·L-1·s-1
(3)在一个绝热(与外界没有热交换)、容积不变的密闭容器中发生可逆反应:N2(g)+3H2(g)![]() 2NH3(g) △H<0。下列各项能说明该反应已经达到平衡状态的是 。
2NH3(g) △H<0。下列各项能说明该反应已经达到平衡状态的是 。
A.容器内气体密度保持不变 B.容器内温度不再变化 C.断裂1mol N≡N键的同时,生成6 mol N—H键 D. 2v正(H2)=3v逆(NH3) E.反应混合气体的平均相对分子质量不变 F.C(H2): C(N2): C(NH3)= 3:1:2
【答案】
(Ⅰ)(1)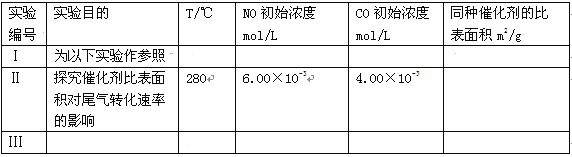 (2)3.00×10-3 mol/L;50%(3)增大
(2)3.00×10-3 mol/L;50%(3)增大
(Ⅱ)(1)B(2)D (3)BDE
【解析】
试题分析:(Ⅰ)(1)探究一种影响因素,必须保持其他影响因素是一致,通过对比Ⅱ和Ⅰ的条件可知,两者的区别是催化剂的比表面积不同,故其他的影响因素均应相同,故Ⅱ中温度为280T,NO初始浓度为6.50×10-3mol/L,CO初始浓度为4.00×10-3mol/L,而且Ⅱ探究的是催化剂比表面积对尾气转化速率的影响,
故答案为:

(2)通过图象可知,平衡时CO的平衡浓度为1.00×10-3mol/L,可得出CO的浓度该变量△c(CO)=4.00×10-3mol/L-1.00×10-3mol/L=3.00×10-3mol/L,在一个反应中,各物质的浓度的改变量之比等于计量数之比,故NO的浓度的该变量△c(NO)=3.00×10-3mol/L,故NO的平衡浓度c(NO)=6.00×10-3mol/L-3.00×10-3mol/L=3.00×10-3mol/L,转化率α ![]() =
=![]() =50%
=50%
故答案为:3.00×10-3mol/L;
(3)由图象可知,增大催化剂比表面积后,缩短了到达平衡的时间,故增大了反应速率。
故答案为:增大。
(II)(1)由于v(N2)=0.15mol/(Ls),速率之比等于化学计量数之比,所以v(NH3)=2v(N2)=2×0.15mol/(Ls)=0.3mol/(Ls),所以反应所经历的时间为 0.9mol/L÷0.3mol/(Ls)=3s,
故答案为:B;
(2)反应为N2(g)+3H2(g)2NH3(g),以氢气的反应速率为标准进行判断:
A.v(H2)=0.1molL-1min-1;B.v(N2)=0.1molL-1min-1,反应速率之比等于其计量数之比,所以v(H2)=3v(N2)=0.3molL-1min-1;C.v(NH3)=0.15molL-1min-1,反应速率之比等于其计量数之比,所以v(H2)=1.5v(NH3)=0.225mol/(Lmin);D.v(N2)=0.002molL-1s-1=0.12molL-1min-1,反应速率之比等于其计量数之比,所以v(H2)=3v(N2)=0.36mol/(Lmin),所以反应速率最快的是D。
故答案为:D;
(3)A.根据质量守恒,反应前后混合气体的质量不变,容器的体积不变,所以混合气体的密度始终不变,不能证明该反应是否达到平衡状态,故A错误;B.该反应放热,容器内温度不再变化,能证明该反应是达到平衡状态,故B正确;C.无论反应是否平衡,断裂1molN≡N键的同时,肯定生成6molN-H键,不能证明该反应达到平衡状态,故C错误;D.无论反应是否平衡,始终有2v正(H2)=3v正(NH3),现已知2v正(H2)=3v逆(NH3),可得v正(NH3) =v逆(NH3),则说明反应已达平衡,故D正确;E.根据质量守恒,反应前后混合气体的质量不变,如果反应混合气体的平均相对分子质量不变,则说明容器中混合气体的物质的量不再变化,由于该反应是气体体积减小的反应,说明该反应已达平衡,故E正确;F.容器中N2、H2、NH3浓度之比可能为1:3:2,也可能不等,与各物质的初始浓度及转化率有关,故F错误。
故答案为:BDE。


科目:高中化学 来源: 题型:
【题目】参考下列(a)~(c)项回答问题:
(a)皂化值是使1g油脂皂化所需要的KOH的毫克数。
(b)碘值是使100g油脂加成碘的克数。
(c)各种油脂的皂化值、碘值列表如下:
花生油 | 亚麻仁油 | 牛油 | 黄油 | 硬化大豆油 | 大豆油 | |
皂化值 | 190 | 180 | 195 | 226 | 193 | 193 |
碘值 | 90 | 182 | 38 | 38 | 5 | 126 |
(1)单纯由(C17H33COO)3C3H5(相对分子质量884)形成的油,皂化值是
(2)在横线上填入适当的词句:
亚麻仁油比花生油所含的_________________多,黄油比牛油的_________________小。硬化大
豆油的碘值小的原因是_________ ________。
(3)为使碘值为180的鱼油100 g硬化所需要的H2的体积为 升(标准状况下)?
(4)结构简式为 的酯,若皂化值为430,求n为
的酯,若皂化值为430,求n为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊。A受热分解的化学方程式为_______________________。
(2)称取两种固体各2 g,分别加入两个小烧杯中,再各加10 mL蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复到室温,向所得溶液中各滴入2滴酚酞溶液。
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论:____________________。
②同学们在两烧杯中还观察到以下现象。其中盛放Na2CO3的烧杯中出现的现象是________(填字母序号)。
a.溶液温度下降 b.溶液温度升高
c.滴入酚酞后呈浅红色 d.滴入酚酞后呈红色
(3)如图所示,在气密性良好的装置Ⅰ和Ⅱ中分别放入药品,将气球内的固体同时倒入试管中。
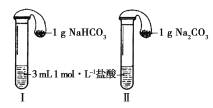
①两试管中均产生气体,________(填“Ⅰ”或“Ⅱ”)的反应程度更为剧烈。
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是________(填字母序号)。
a.装置Ⅰ的气球体积较大
b.装置Ⅱ的气球体积较大
c.生成气体的体积根据盐酸计算
d.生成气体的体积根据固体计算
(4)同学们将两种固体分别配制成0.5 mol·L-1的溶液,设计如下方案并对反应现象做出预测:
实验方案 | 预测现象 | 预测依据 |
操作1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol·L-1 CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应:________(写离子方程式) |
操作2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol·L-1 CaCl2溶液 | 无白色沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应 |
实施实验后,发现操作2的现象与预测有差异:产生白色沉淀和气体,则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:
2Mg5Al3(OH)19(H2O)4 ![]() 27H2O↑+10MgO+3Al2O3
27H2O↑+10MgO+3Al2O3
(1)写出该化合物作阻燃剂的两条依据____________。
(2)用离子方程式表示除去固体产物中Al2O3 的原理________。
(3)已知MgO可溶于NH4Cl的水溶液,用化学方程式表示其原理____________。
Ⅱ.磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组成:
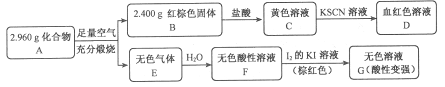
请回答:
(1)A的组成元素为_________(用元素符号表示),化学式为______。
(2)溶液C可溶解铜片,例举该反应的一个实际应用____________。
(3)已知化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518 g·L-1),该气体分子的电子式为____。写出该反应的离子方程式__________。
(4)写出F→G反应的化学方程式_____________。设计实验方案探究溶液G中的主要微粒(不考虑H2O、H+、K+、I-)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如下:
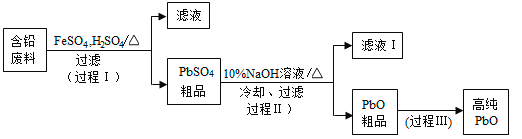
(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是__________。
(2)过程Ⅰ中,Fe2+催化过程可表示为:
i:2Fe2++ PbO2+4H++SO42=2Fe3++PbSO4+2H2O
ii: ……
①写出ii的离子方程式:________________。
②下列实验方案可证实上述催化过程。将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红。
b.______________。
(3)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq),其溶解度曲线如图所示。
NaHPbO2(aq),其溶解度曲线如图所示。
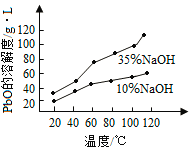
①过程Ⅱ的目的是脱硫。滤液1经处理后可在过程Ⅱ中重复使用,其目的是_____(选填序号)。
A.减少PbO的损失,提高产品的产率
B.重复利用氢氧化钠,提高原料的利用率
C.增加Na2SO4浓度,提高脱硫效率
②过滤Ⅲ的目的是提纯,综合上述溶解度曲线,简述过程Ⅲ的操作_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的工业原料,能溶于水,不溶于乙醇,其工业制法如下。请回答:
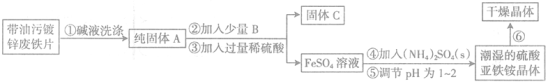
(1)步骤①中碱液洗涤的目的是 。若将碱液换为酸液,可能产生的问题是_ 。
(2)步骤②中B可以是 (填字母),加入少量B的目的是 。
a.CuCl2 b.CuO c.Cu(NO3)2 d.CuSO4
(3)步骤⑥中要用到少量乙醇洗涤,其目的是 。
(4)用硫酸亚铁按晶体配制溶液时,需加入一定量硫酸,目的是 。工业上常用酸性KMnO4溶液通过滴定的方法测定硫酸亚铁铵样品的纯度,反应的离子方程式为 。准确量取硫酸亚铁铵溶液时,硫酸亚铁铵溶液应盛放于 (填“酸式”或“碱式”)滴定管中。
(5)硫酸亚铁铵晶体的样品中可能含有的杂质离子是 ,实验室的检验方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,此外还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下:
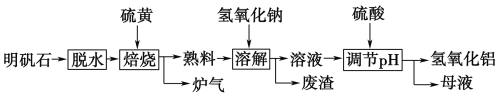
(1)“焙烧”过程中反应的化学方程式为2Al2(SO4)3+3S2Al2O3+________;该反应的氧化剂是________;该反应中被氧化的元素与被还原的元素的质量比是________。
(2)“溶解”时反应的离子方程式为___________________________。
(3)“调节pH”后过滤、洗涤Al(OH)3沉淀,证明已洗涤干净的实验操作和现象是_________________。
(4)“母液”中可回收的物质是__________________________。
(5)工业上常用氢氧化铝脱水后的产物X熔融电解冶炼金属铝,则该反应的化学方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NaCl、CO2、NH3为原料发生反应,制得NaHCO3和NH4Cl是“侯氏制碱法”的重要步骤。相关物质的溶解度曲线如图所示。下列说法不正确的是
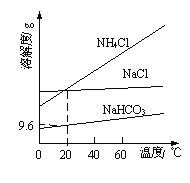
A.将NaHCO3加热分解可得纯碱
B.常温下碳酸氢钠的溶解度大于碳酸钠
C.采用蒸发结晶从溶液中分离出NaHCO3
D.20℃时,NaHCO3饱和溶液的物质的量浓度约为1.1mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com