
【题目】已知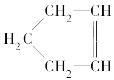 可简写为
可简写为![]() 。降冰片烯的分子结构可表示为
。降冰片烯的分子结构可表示为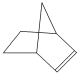 。
。
(1)降冰片烯属于________。
A.环烃 B.不饱和烃
C.烷烃 D.芳香烃
(2)下列对降冰片烯的性质的说法不正确的是________。
A.它可使酸性KMnO4溶液退色
B.它能使溴的四氯化碳溶液退色
C.它能溶于水
D.它燃烧时可发出明亮的火焰
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知乙酸中的氧都是18O,则乙酸和乙醇在一定条件下反应,经过足够长的时间后,体系中含有18O的物质是
A. 只有乙酸
B. 只有乙酸乙酯
C. 乙酸、乙酸乙酯、水
D. 乙酸乙酯、乙醇、水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.4molX气体和0.6molY气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g) ![]() nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
(1)前2min内用W的浓度变化表示的平均反应速率为_______________。
(2)2min末时Y的浓度为_____________________________。
(3)化学反应方程式中n=_____________________________。
(4)2min末,恢复到反应前温度,体系内压强是反应前压强的__________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于分子组成表示为CxHy的烷、烯、炔烃说法不正确的是( )
A.当x≤4时,常温、常压下均为气体
B.y一定是偶数
C.分别燃烧1 mol,耗氧气为(x+![]() )mol
)mol
D.在密闭容器中完全燃烧,150℃时测得的压强一定比燃烧前压强大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:① R-NO2![]() R-NH2;
R-NH2;
②苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。
以下是用苯为原料制备某些化合物的转化关系图:
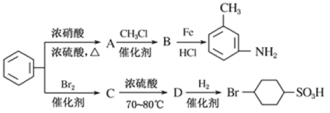
(1)A 转化为B 的化学方程式是____________________________;
(2)在“![]() ”的所有反应中属于取代反应的是______________(填字母),属于加成反应的是__________________(填字母);C 转化为D 的化学方程式是_________________;
”的所有反应中属于取代反应的是______________(填字母),属于加成反应的是__________________(填字母);C 转化为D 的化学方程式是_________________;
(3)B 中苯环上的一氯代物有_______________种同分异构体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地球上的物质不断变化,数10亿年来大气的成分也发生了很大的变化。下表是原始大气和目前空气的主要成分:
目前空气的成分 | N2、O2、CO2、水蒸气及稀有气体(如He、Ne等) |
原始氮气的主要成分 | CH4、NH3、CO、CO2等 |
用上表所涉及的分子填写下列空白。
(1)含有10个电子的分子有(填化学式,下同)______________________;
(2)由极性键构成的非极性分子有____________________;
(3)与H+可直接形成配位键的分子有________;
(4)沸点最高的物质是________,用所学的知识解释其沸点最高的原因_____________;
(5)分子中不含孤电子对的分子(稀有气体除外)有________,它的立体构型为________;
(6)极易溶于水、且水溶液呈碱性的物质的分子是________,它之所以极易溶于水是因为它的分子和水分子之间形成________;
(7)CO的结构可表示为O![]() C,与CO结构最相似的分子是________,这两种结构相似的分子中,分子的极性________(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个键不同,它叫________。
C,与CO结构最相似的分子是________,这两种结构相似的分子中,分子的极性________(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个键不同,它叫________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为部分短周期非金属元素的性质或原子结构,已知A﹣D的原子序数依次增大。
元素编号 | 元素性质或原子结构 |
A | A原子所处的周期数、族序数、原子序数均相等 |
B | 核外电子有6种不同运动状态 |
C | 最简单氢化物的水溶液呈碱性 |
D | 基态原子的s轨道电子数等于p轨道电子数 |
请结合表中信息完成下列各小题(答题时用所对应的元素符号):
(1)写出C原子的电子排布图________。
(2)A,B,C,D的第一电离能由大到小的顺序为________。
(3)用电离方程式表示C的最简单氢化物的水溶液呈碱性的原因________。按照共价键理论,分子中每个原子的最外电子层电子数均已饱和,已知ABCD分子可能有三种不同结构,它们的结构可以从其他物质的结构中获得启发。
(4)ABC的结构式是______,向其中插入一个D原子,若形成配位键(用→表示)则ABCD的结构式为_______,分子中C的原子的杂化类型是______;若无配位键则ABCD的结构式为______分子中D原子的杂化类型为________。
(5)BD2的电子式是________将D原子换成等电子的 ![]() 所得ABCD的结构式为_______,分子中C原子的杂化类型是_______。
所得ABCD的结构式为_______,分子中C原子的杂化类型是_______。
(6)在ABCD的三种可能结构中B原子的杂化类型________(填“相同”或“不相同”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源与材料、信息被称为现代社会发展的三大支柱,化学与能源有着密切联系。
(1)下表中的数据表示破坏1mol化学键需消耗的能量(即键能,单位为kJmol-1)
化学键 | H-H | Cl-Cl | H-Cl |
键能/(kJmol-1) | 436 | 243 | 431 |
根据以上信息可知,1molH2在足量的氯气中燃烧生成氯化氢气体放出的热量是_______
(2)工业上有一种方法是用CO2来生产燃料甲醇,可以将CO2变废为宝。在体积为1L的密闭容器中充入1molCO2和3molH2,一定条件下发生反应CO2(g)+3H2(g)CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:
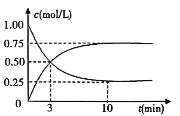
①从反应开始到平衡,CH3OH的平均反应速率υ(CH3OH)=_______________。
②若反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)在四种不同情况下的反应速率分别为:
A.υ(CO2)=0.15molL-1min-1 B.υ(H2)=0.01molL-1s-1
C.υ(CH3OH)=0.2molL-1min-1 D.υ(H2O)=0.45molL-1min-1
该反应进行由快到慢的顺序为___________(填字母)
(3)海水化学资源的利用具有非常广阔的前景,从海水中提取溴的工业流程如图所示:
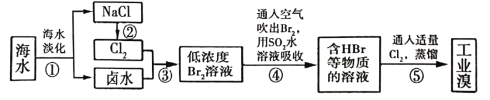
①以上五个过程中涉及氧化还原反应的有_____________个。
②步骤③中已获得游离态的溴,步骤④又随之转变成化合态的溴,其目的是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com