
【题目】下表为部分短周期非金属元素的性质或原子结构,已知A﹣D的原子序数依次增大。
元素编号 | 元素性质或原子结构 |
A | A原子所处的周期数、族序数、原子序数均相等 |
B | 核外电子有6种不同运动状态 |
C | 最简单氢化物的水溶液呈碱性 |
D | 基态原子的s轨道电子数等于p轨道电子数 |
请结合表中信息完成下列各小题(答题时用所对应的元素符号):
(1)写出C原子的电子排布图________。
(2)A,B,C,D的第一电离能由大到小的顺序为________。
(3)用电离方程式表示C的最简单氢化物的水溶液呈碱性的原因________。按照共价键理论,分子中每个原子的最外电子层电子数均已饱和,已知ABCD分子可能有三种不同结构,它们的结构可以从其他物质的结构中获得启发。
(4)ABC的结构式是______,向其中插入一个D原子,若形成配位键(用→表示)则ABCD的结构式为_______,分子中C的原子的杂化类型是______;若无配位键则ABCD的结构式为______分子中D原子的杂化类型为________。
(5)BD2的电子式是________将D原子换成等电子的 ![]() 所得ABCD的结构式为_______,分子中C原子的杂化类型是_______。
所得ABCD的结构式为_______,分子中C原子的杂化类型是_______。
(6)在ABCD的三种可能结构中B原子的杂化类型________(填“相同”或“不相同”)。
【答案】![]() N>O>C>H NH3H2ONH4++OH﹣ H﹣C≡N H﹣C≡N→O sp H﹣O﹣C≡N sp3
N>O>C>H NH3H2ONH4++OH﹣ H﹣C≡N H﹣C≡N→O sp H﹣O﹣C≡N sp3 ![]() H﹣N=C=O sp2 相同
H﹣N=C=O sp2 相同
【解析】
短周期非金属元素A-D的原子序数依次增大,A原子所处的周期数、族序数、原子序数均相等,则A为氢元素;B核外电子有6种不同运动状态,即核外电子数为6,则B为碳元素;C最简单氢化物的水溶液呈碱性,则C为氮元素;D基态原子的s轨道电子数等于p轨道电子数,则其核外电子排布式为1s22s22p4或1s22s22p63s2,为非金属性元素,则其核外电子排布式为1s22s22p4,则D为氧元素,据此分析解答。
根据上述分析,A为氢元素,B为碳元素,C为氮元素,D为氧元素。
(1)C为氮元素,原子核外有7个电子,原子的电子排布图为![]() ,故答案为:
,故答案为:![]() ;
;
(2)同周期自左而右第一电离能呈增大趋势,但N元素的2p容纳了3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能N>O>C>H,故答案为:N>O>C>H;
(3)C的最简单氢化物为NH3,其水溶液中NH3H2O发生电离NH3H2ONH4++OH-,使溶液呈碱性,故答案为:NH3H2ONH4++OH-;
(4)ABC的化学式为HCN,HCN分子中C原子与N原子之间形成3对共用电子对,C原子与H原子之间形成1对共用电子对,故HCN的结构式是为H-C≡N;向其中插入一个O原子,若形成配位键,N原子通过孤对电子、O原子通过空轨道形成配位键,则HCNO的结构式为H-C≡N→O,分子中N原子成1个σ键、含1对孤对电子,N原子采取sp杂化;若无配位键则HCNO中,O原子应在H-C≡N中H-C键之间插入,其结构式为H-O-C≡N,分子中O原子成2个σ键、含2对孤对电子,O原子采取sp3杂化,故答案为:H-C≡N;H-C≡N→O;sp;H-O-C≡N;sp3;
(5)BD2为CO2,CO2的电子式是![]() ,将D原子换成等电子的
,将D原子换成等电子的![]() ,根据稳定结构可知,N与C之间形成2对共用电子对,故所得ABCD的结构式为 H-N=C=O,分子中N原子成2个σ键、含1对孤对电子,N原子采取sp2杂化,故答案为:
,根据稳定结构可知,N与C之间形成2对共用电子对,故所得ABCD的结构式为 H-N=C=O,分子中N原子成2个σ键、含1对孤对电子,N原子采取sp2杂化,故答案为:![]() ;H-N=C=O;sp2;
;H-N=C=O;sp2;
(6)在ABCD的三种可能结构中C原子都成2个σ键、不含孤对电子,C原子均采取sp杂化,故答案为:相同。


科目:高中化学 来源: 题型:
【题目】下表为元素周期表中的一部分,表中列出8种元素在周期表中的位置,按要求回答下列问题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ④ | ⑥ | ||||||
3 | ① | ② | ③ | ⑤ | ⑦ | ⑧ |
(1)在①~⑧元素中化学性质最不活泼的元素的名称是____,金属性最强的元素的名称是____。
(2)③、④、⑥三种元素中的原子半径最小的是_____________(填元素符号)。
(3)①、②、③三种元素形成的离子,离子半径由大到小的顺序是____(用离子符号填写)。
(4)④与⑥形成的化合物的电子式为_____________。
(5)写出①和③两种元素的最高价氧化物对应的水化物相互反应的离子方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知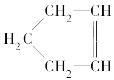 可简写为
可简写为![]() 。降冰片烯的分子结构可表示为
。降冰片烯的分子结构可表示为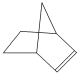 。
。
(1)降冰片烯属于________。
A.环烃 B.不饱和烃
C.烷烃 D.芳香烃
(2)下列对降冰片烯的性质的说法不正确的是________。
A.它可使酸性KMnO4溶液退色
B.它能使溴的四氯化碳溶液退色
C.它能溶于水
D.它燃烧时可发出明亮的火焰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】久置的FeSO4溶液变黄,一般认为是二价铁被氧化为三价铁的缘故。某研究小组为研究溶液中Fe2+被O2氧化的过程,查阅资料发现:溶液中Fe2+的氧化过程分为先后两步,首先是Fe2+水解,接着水解产物被O2氧化。于是小组同学决定研究常温下不同pH对Fe2+被O2氧化的影响,并测定了Fe2+氧化率随时间变化的关系,结果如图。回答下列问题:
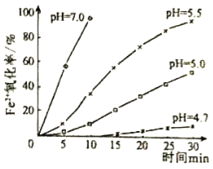
(1)写出Fe2+水解的离子方程式______;要抑制FeSO4水解,可以采取的措施是______。
(2)在酸性条件下,Fe2+被O2氧化的反应方程式为:4Fe2++O24Fe3++2H2O,已知常温下该反应的平衡常数很大。则下列说法正确的是______。
a.Fe2+转化为Fe3+的趋势很大 b.Fe2+转化为Fe3+的速率很大
c.该反应进行得很完全 d.酸性条件下Fe2+不会被氧化
(3)结合如图分析不同pH对Fe2+被O2氧化的反应发生了怎样的影响______。
(4)研究小组在查阅资料时还得知:氧气的氧化性随溶液的酸性增强而增强。通过以上研究可知,配制FeSO4溶液的正确做法是______。
(5)用K2Cr2O7标准溶液测定溶液中Fe2+浓度,从而计算Fe2+的氧化率。反应如下:6Fe2++Cr2O72-+14H+→2Cr3++6Fe3++7H2O若取20mL待测溶液,用0.0200molL-1KCr2O7标准溶液滴定,消耗标准溶液16.50mL,则溶液中c(Fe2+)=______molL-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能够充分说明在恒温下的密闭容器中,反应2SO2+O2![]() 2SO3已达平衡状态的标志是
2SO3已达平衡状态的标志是
A. 容器中SO2.O2.SO3的物质的量之比为2:1:2
B. SO2 和SO3的物质的量浓度相等
C. 单位时间内生成2molSO3 时,即消耗1molO2
D. 反应容器内压强不随时间变化而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮元素是构成生物体的主要元素,在动植物生命活动中起着重要作用。根据要求回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用____________形象化描述。在基态14C原子中,核外存在____________对自旋状态相反的电子。
(2)已知:(NH4)2CO3![]() 2NH3↑+H2O↑+CO2↑
2NH3↑+H2O↑+CO2↑
①与氧同周期,且第一电离能比氧大的元素有____________种。
②(NH4)2CO3分解所得的气态化合物分子的键角由小到大的顺序为____________(填化学式)。
(3)物质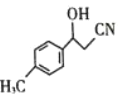 中C原子杂化方式是____________。
中C原子杂化方式是____________。
(4)配合物[Cu(CH3C![]() N)4]BF4中,铜原子的价电子布式为____________,BF4-的空间构型为___________。写出与BF4-互为等电子体的一种分子和一种离子的化学式:___________、___________。
N)4]BF4中,铜原子的价电子布式为____________,BF4-的空间构型为___________。写出与BF4-互为等电子体的一种分子和一种离子的化学式:___________、___________。
(5)碳元素与氮元素形成的某种晶体的晶胞如图所示(8个碳原子位于立方体的顶点,4个碳原子位于立方体的面心,4个氮原子在立方体内),该晶体硬度超过金刚石,成为首屈一指的超硬新材料。
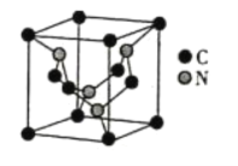
①晶胞中C原子的配位数为___________。该晶体硬度超过金刚石的原因是___________。
②已知该晶胞的边长为apm,阿伏加德罗常数用NA表示,则该晶体的密度为___________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为![]() 。下列说法正确的是
。下列说法正确的是
A. 1L0.1mol·![]() NH4Cl溶液中,
NH4Cl溶液中, ![]() 的数量为0.1
的数量为0.1![]()
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1![]()
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2![]()
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学--选修5:有机化学基础]
氰基丙烯酸酯在碱性条件下能快速聚合为 ,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:

已知:
①A的相对分子量为58,氧元素质量分数为0.276,核磁共振氢谱显示为单峰
②
回答下列问题:
(1)A的化学名称为_______。
(2)B的结构简式为______,其核磁共振氢谱显示为______组峰,峰面积比为______。
(3)由C生成D的反应类型为________。
(4)由D生成E的化学方程式为___________。
(5)G中的官能团有___、 ____ 、_____。(填官能团名称)
(6)G的同分异构体中,与G具有相同官能团且能发生银镜反应的共有_____种。(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Cu和CuO的混合物中加入0.6 L 2.0 mol/L的稀硝酸,混合物完全溶解,同时生成标准状况下NO 4.48 L。向所得溶液中加入一定体积1.0 mol/L NaOH溶液,恰好使Cu2+完全沉淀,将沉淀洗涤,充分灼烧后得32.0 g固体。求:
(1)混合物中Cu的质量是____________。
(2)混合物消耗HNO3的物质的量是____________。
(3)NaOH溶液的体积是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com