
����Ŀ����Դ����ϡ���Ϣ����Ϊ�ִ���ᷢչ������֧������ѧ����Դ����������ϵ��
(1)�±��е����ݱ�ʾ�ƻ�1mol��ѧ�������ĵ�����(�����ܣ���λΪkJmol��1)
��ѧ�� | H��H | Cl��Cl | H��Cl |
����/(kJmol��1) | 436 | 243 | 431 |
����������Ϣ��֪��1molH2��������������ȼ�������Ȼ�������ų���������_______
(2)��ҵ����һ�ַ�������CO2������ȼ�ϼ״������Խ�CO2���Ϊ���������Ϊ1L���ܱ������г���1molCO2��3molH2��һ�������·�����ӦCO2(g)+3H2(g)CH3OH(g)+H2O(g)�����CO2(g)��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��
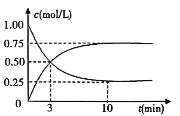
�ٴӷ�Ӧ��ʼ��ƽ�⣬CH3OH��ƽ����Ӧ������(CH3OH)=_______________��
������ӦCO2(g)+3H2(g)CH3OH(g)+H2O(g)�����ֲ�ͬ����µķ�Ӧ���ʷֱ�Ϊ��
A����(CO2)=0.15molL��1min��1 B����(H2)=0.01molL��1s��1
C����(CH3OH)=0.2molL��1min��1 D����(H2O)=0.45molL��1min��1
�÷�Ӧ�����ɿ쵽����˳��Ϊ___________(����ĸ)
(3)��ˮ��ѧ��Դ�����þ��зdz�������ǰ�����Ӻ�ˮ����ȡ��Ĺ�ҵ������ͼ��ʾ��
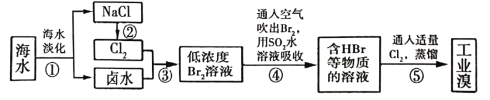
����������������漰������ԭ��Ӧ����_____________����
�ڲ�������ѻ������̬���壬���������֮ת��ɻ���̬���壬��Ŀ����__________��
���𰸡�183 kJ 0.075mol/(Lmin) D��C=B��A(��D��B = C��A) 4 ����(��Ũ��)��Ԫ��
��������
���ü��ܼ��㷴Ӧ��ʱ����Ӧ�ų�������Ӧ����������ļ����ܺ��뷴Ӧ��ļ����ܺ�֮�CH3OH(g)Ϊ��������ʵ���Ũ��Ӧ��0��ʼ��Ȼ���������մ�ƽ�⣬���ʾ������ӦΪ����ʱ���ڵ�Ũ�ȱ仯�������ò�ͬ���ʵ����ʱȽϷ�Ӧ���ʵĿ���ʱ����ת��Ϊͬһ�����ʣ���ע�ⵥλ��ͳһ���Ӻ�ˮ����ȡ�壬������Ϊ���ú�ˮ������NaCl�ᾧ������±ˮ�к���Br-��������Ϊ��ⱥ��ʳ��ˮ��Cl2���������ǽ����ɵ�Cl2ͨ��±ˮ�л�ú���Ũ��Br2����Һ�������������ÿ�����Br2������Ȼ����SO2ˮ��Һ���գ����������������������ǽ���Һ�е����������������������ò��ᆳ����ɵô�������������
(1)�����Ϸ���֪��1molH2��������������ȼ�������Ȼ������壬�ų���������2��431kJ-436kJ-243kJ=183 kJ����Ϊ��183 kJ��
(2)����ΪCH3OHΪ�������ʼ��ӦΪ0������ͼ�����������߱���CH3OH��Ũ�ȱ仯���ߣ�CH3OH��ƽ����Ӧ������(CH3OH)=![]() = 0.075mol/(Lmin)����Ϊ��0.075mol/(Lmin)��
= 0.075mol/(Lmin)������0.075mol/(Lmin)��
��Ϊ���ڱȽϣ����÷�ӦCO2(g)+3H2(g)CH3OH(g)+H2O(g)�����ֲ�ͬ����µķ�Ӧ���ʷֱ�ת������(CO2)��
A����(CO2)=0.15molL��1min��1 ��
B����(H2)=0.01molL��1s��1����(CO2)=0.2molL��1min��1 ��
C����(CH3OH)=0.2molL��1min��1����(CO2)=0.2molL��1min��1 ��
D����(H2O)=0.45molL��1min��1����(CO2)=0.45molL��1min��1 ��
�Ƚ��������ݣ��ɵó��÷�Ӧ�����ɿ쵽����˳��ΪD��C=B��A(��D��B = C��A)����Ϊ��D��C=B��A(��D��B = C��A)��
(3)����������������漰������ԭ��Ӧ���Тڢۢܢݣ���4����
�ڲ�������ѻ������̬���壬��Ũ��С�����������֮ת��ɻ���̬���壬��Ũ�ȴ�������Ŀ���Ǹ���(��Ũ��)��Ԫ�ء���Ϊ��4������(��Ũ��)��Ԫ�ء�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪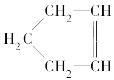 �ɼ�дΪ
�ɼ�дΪ![]() ������Ƭϩ�ķ��ӽṹ�ɱ�ʾΪ
������Ƭϩ�ķ��ӽṹ�ɱ�ʾΪ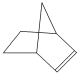 ��
��
(1)����Ƭϩ����________��
A������ B����������
C������ D��������
(2)���жԽ���Ƭϩ�����ʵ�˵������ȷ����________��
A������ʹ����KMnO4��Һ��ɫ
B������ʹ������Ȼ�̼��Һ��ɫ
C����������ˮ
D����ȼ��ʱ�ɷ��������Ļ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ӵ�������ֵΪ![]() ������˵����ȷ����
������˵����ȷ����
A. 1L0.1mol��![]() NH4Cl��Һ�У�
NH4Cl��Һ�У� ![]() ������Ϊ0.1
������Ϊ0.1![]()
B. 2.4gMg��H2SO4��ȫ��Ӧ��ת�Ƶĵ�����Ϊ0.1![]()
C. ��״���£�2.24LN2��O2�Ļ�������з�����Ϊ0.2![]()
D. 0.1mol H2��0.1mol I2���ܱ������г�ַ�Ӧ�����������Ϊ0.2![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ--ѡ��5���л���ѧ����]
�����ϩ�����ڼ����������ܿ��پۺ�Ϊ ���Ӷ����н���ԣ�ij�������ϩ������G���ĺϳ�·�����£�
���Ӷ����н���ԣ�ij�������ϩ������G���ĺϳ�·�����£�

��֪��
��A����Է�����Ϊ58����Ԫ����������Ϊ0.276���˴Ź���������ʾΪ����
��
�ش��������⣺
��1��A�Ļ�ѧ����Ϊ_______��
��2��B�Ľṹ��ʽΪ______����˴Ź���������ʾΪ______��壬�������Ϊ______��
��3����C����D�ķ�Ӧ����Ϊ________��
��4����D����E�Ļ�ѧ����ʽΪ___________��
��5��G�еĹ�������___�� ____ ��_____��������������ƣ�
��6��G��ͬ���칹���У���G������ͬ���������ܷ���������Ӧ�Ĺ���_____�֡������������칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����¯����ʱ�ô�������������Ʒ�����ݲ��������ȷ���л������ɣ�����װ������ȼ�շ�ȷ���л������ʽ���õ�װ�á�
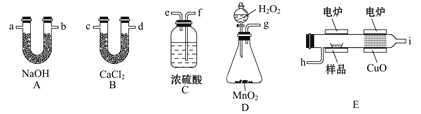
(1)�����������������ҵ�������ѡװ�ø����ܵ�����˳����___________��
(2)Cװ����ŨH2SO4��������________��
(3)Dװ����MnO2��������_____________��
(4)ȼ�չ���CuO��������______________��
(5)��ȷ��ȡ0.90 g��Ʒ(ֻ��C��H��O����Ԫ���е����ֻ�����)�������ȼ�պ�A����������1.32g��B����������0.54 g������л����ʵ��ʽΪ_______��
(6)Ҫȷ�����л���ķ���ʽ����Ҫ֪��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2013���й�ˮ�ܵ������ǣ�����Լ����ˮ��Դ������������̬��������
��1��ClO2��Cl2����ԭ���ﶼΪCl�����������г��õľ�ˮ�������������ĵ����ʵ�������������ʱ��ClO2������Ч����Cl2��_________����
��2��ij��ɫ��ˮ�п��ܺ���Fe3+��Al3+��Mg2+��Na+��NO3-��CO32����SO42���еļ��֣�Ϊ������ɷ֣��ֱ�ȡ��ˮ��Ʒ100mL������������ʵ�飬��������̺��й�������ͼ��ʾ�������������ͼ����ͼ
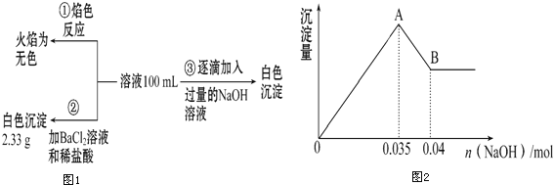
�������ͼ�ش��������⣺
��ʵ����������1.0molL��1��NaOH��Һ100mL�������������˲�������������ƽ����Ͳ��ҩ�ס��ձ�����ͷ�ιܣ���ȱ�ٵ�����Ϊ_______________��
��ʵ�����г�������A��B��������������Ӧ�����ӷ���ʽΪ___________��
����ȷ��NO3-�Ƿ���ڣ�________����������������������������ȷ�������������ڣ��Լ���c��NO3-��=_____���������ڣ����ʲ������𣩣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ע�����м�������Na2SO3���壬����������Ũ����(�Բ��Ӵ�ֽ��Ϊ)���������й�˵����ȷ����(����)
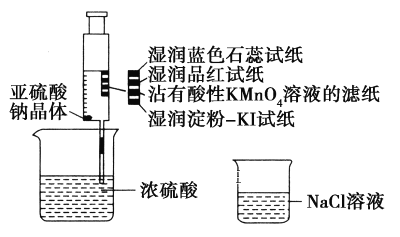
A. ��ɫʯ����ֽ�ȱ�����ɫ
B. Ʒ����ֽ��մ������KMnO4��Һ����ֽ����ɫ��֤��SO2����Ư����
C. ʪ����ۣ�KI��ֽδ����˵��SO2������������I2
D. NaCl��Һ�����ڳ�ȥʵ���ж����SO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Cu��CuO�Ļ�����м���0.6 L 2.0 mol/L��ϡ���ᣬ�������ȫ�ܽ⣬ͬʱ���ɱ�״����NO 4.48 L����������Һ�м���һ�����1.0 mol/L NaOH��Һ��ǡ��ʹCu2����ȫ������������ϴ�ӣ�������պ��32.0 g���塣��
(1)�������Cu��������____________��
(2)���������HNO3�����ʵ�����____________��
(3)NaOH��Һ�������____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С���о���ͭ���Ϸ��ϣ������ڣ�����Ag2S�����������ʼ��Ʊ�����ͭ���壬�������£��������е��������������ϵͣ���ʵ��Ӱ��ɺ��ԣ�
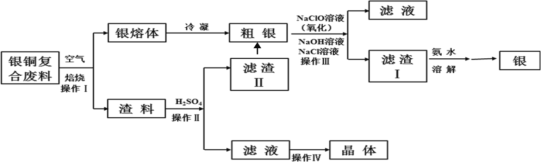
��֪����AgCl�����ڰ�ˮ������[Ag(NH3)2]+��
��Ksp��Ag2SO4��=1.2��105��Ksp��AgCl��=1.8��1010��
�������к��������������������ܣ���
��1������I��Ϊ�˼ӿ�����������ʣ����Բ�ȡ_______��ʩ(д������һ�ּ���)��
��2������IV����________��_______���ˡ�ϴ�Ӻ�����Եõ�����ͭ���塣
��3��ϴ������II��������ϲ���Ŀ����__________��
��4������III�У�NaClO��Һ��Ag��Ӧ�IJ���ΪAgCl��NaOH��NaCl��O2���÷�Ӧ�Ļ�ѧ����ʽΪ______������AgCl��NaCl�����ʵ���֮��Ϊ2��1����������ͬʱ��������ת�������ӷ���ʽΪ_____����ƽ�ⳣ��K=__________��
��5���ڿ����м���5.20g����ͭ����(CuSO4��5H2O)��Ʒ�����ȹ����в�ͬ�¶ȷ�Χ�ڷֱ�õ�һ�ֹ������ʣ����������������֪CuSO4��5H2O��Է�������250��
�¶ȷ�Χ/�� | ��������/g |
200~260 | 3.33 |
650~800 | 1.67 |
1000~1500 | 1.50 |
���ȵ�1000��ʱ���������ʵĻ�ѧʽΪ��_______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com