
����Ŀ����Ԫ�صĻ���������࣬����Ҳ������ͬ����ش��������⣺
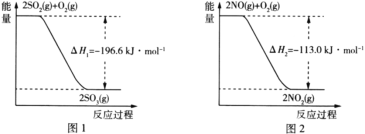
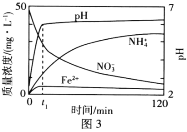
��1��NO2�н�ǿ�������ԣ��ܽ�SO2������SO3����������ԭΪNO����֪��������Ӧ�����������仯��ͼ1��ͼ2��ʾ����NO2����SO2����SO3(g)���Ȼ�ѧ����ʽΪ____��
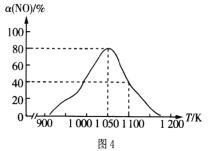
��2���ڵ��������£���ʵ��������������Fe�ۻ�ԭKNO3��Һ��pH =2.5������Ӧ��������Һ��������ӵ�����Ũ�ȡ�pH��ʱ��ı仯���ߣ����ָ���Ӧ����������ȥ����ͼ3��ʾ�������ͼ3����Ϣд��![]() minǰ��Ӧ�����ӷ���ʽ____��
minǰ��Ӧ�����ӷ���ʽ____��
��3���о���Ա�û���̿������β���е�NO����������������ӦC(s) +2NO(g)![]() N2(g) +CO2(g)
N2(g) +CO2(g) ![]() H<0���ں�ѹ�ܱ������м��������Ļ���̿��һ������NO���壬��Ӧ��ͬʱ��ʱ�����NO��ת����
H<0���ں�ѹ�ܱ������м��������Ļ���̿��һ������NO���壬��Ӧ��ͬʱ��ʱ�����NO��ת����![]() (NO)���¶ȵı仯��ͼ4��ʾ��
(NO)���¶ȵı仯��ͼ4��ʾ��
����ͼ4��֪���¶ȵ���1 050 Kʱ��NO��ת�������¶����߶�����ԭ����__���¶�Ϊ1050 KʱCO2��ƽ���������Ϊ__��
�����ڷ�ӦC(s) +2NO(g)![]() N2(g)+CO2(g)�ķ�Ӧ��ϵ����ƽ�ⳣ��
N2(g)+CO2(g)�ķ�Ӧ��ϵ����ƽ�ⳣ��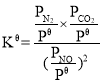 ������
������![]() Ϊ��ѹǿ��1��105Pa����
Ϊ��ѹǿ��1��105Pa����![]() ��
��![]() ��
��![]() Ϊ����ֵ�ƽ���ѹ����
Ϊ����ֵ�ƽ���ѹ����![]() =
=![]() ��
��![]() ��
��![]() Ϊƽ����ѹ��
Ϊƽ����ѹ��![]() Ϊƽ��ϵͳ�� NO�����ʵ�����������NO����ʼ���ʵ���Ϊ1 mol�����跴Ӧ�ں㶨�¶Ⱥͱ�ѹǿ�½��У�NO��ƽ��ת����Ϊ
Ϊƽ��ϵͳ�� NO�����ʵ�����������NO����ʼ���ʵ���Ϊ1 mol�����跴Ӧ�ں㶨�¶Ⱥͱ�ѹǿ�½��У�NO��ƽ��ת����Ϊ![]() ����
����![]() =__���ú�
=__���ú�![]() �����ʽ��ʾ����
�����ʽ��ʾ����
��4�������ִ��ֳּ���������̽��ѹǿ��2NO2 (g)![]() N2O4(g)ƽ���ƶ���Ӱ�졣�ں㶨�¶Ⱥͱ�ѹǿ�����£�����Ͳ�г���һ�������NO2������ܷⲢ���ֻ���λ�ò��䡣�ֱ���
N2O4(g)ƽ���ƶ���Ӱ�졣�ں㶨�¶Ⱥͱ�ѹǿ�����£�����Ͳ�г���һ�������NO2������ܷⲢ���ֻ���λ�ò��䡣�ֱ���![]() s��
s��![]() sʱѸ���ƶ��������ֻ���λ�ò��䣬�ⶨ��Ͳ������ѹǿ�仯��ͼ5��ʾ��
sʱѸ���ƶ��������ֻ���λ�ò��䣬�ⶨ��Ͳ������ѹǿ�仯��ͼ5��ʾ��
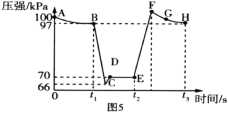
��B��E�����Ӧ������Ӧ���ʴ�СΪ![]() __������ > ���� < ������ =����
__������ > ���� < ������ =����![]() ��
��
��E��F��G��H�ĵ��Ӧ�����ƽ����Է����������ĵ�Ϊ__��
���𰸡�NO2(g)��SO2(g)=SO3(g)��NO(g) ��H=��41.8kJ��mol��1 4Fe��NO3����10H��=4Fe2����NH4����3H2O �¶ȵ���1050Kʱ����Ӧδ�ﵽƽ��״̬�����¶����ߣ���Ӧ���ʼӿ죬NOת�������� 40% ![]() > H
> H
��������
(1)����ͼ1��ͼ2�е���Ϣ���ɵ��Ȼ�ѧ����ʽ��2SO2(g)��O2(g)![]() 2SO3(g) ��H1=��196.6kJ��mol��1����2NO(g)��O2(g)
2SO3(g) ��H1=��196.6kJ��mol��1����2NO(g)��O2(g)![]() 2NO2(g) ��H2=��113.0kJ��mol��1��
2NO2(g) ��H2=��113.0kJ��mol��1��![]() (��Ӧ�٣���Ӧ��)�ɵ�NO2����SO2�ķ�Ӧ����ʽ��NO2(g)��SO2(g)=NO(g)��SO3(g) ��H=
(��Ӧ�٣���Ӧ��)�ɵ�NO2����SO2�ķ�Ӧ����ʽ��NO2(g)��SO2(g)=NO(g)��SO3(g) ��H=![]() (��H1����H2)=
(��H1����H2)=![]() [��196.6kJ��mol��1��(��113.0kJ��mol��1)]=��41.8kJ��mol��1����NO2����SO2����SO3(g)���Ȼ�ѧ����ʽΪNO2(g)��SO2(g)=SO3(g)��NO(g)��H=��41.8kJ��mol��1��
[��196.6kJ��mol��1��(��113.0kJ��mol��1)]=��41.8kJ��mol��1����NO2����SO2����SO3(g)���Ȼ�ѧ����ʽΪNO2(g)��SO2(g)=SO3(g)��NO(g)��H=��41.8kJ��mol��1��
(2)����ͼ��t1minǰ����ҺΪ���ԣ���Ӧ��pH��������NO3�������ڼ�С����Fe2����NH4�����������ӣ�˵��Fe��NO3����Ӧ����Fe2����NH4�������ӷ���ʽΪ4Fe��NO3����10H��=4Fe2����NH4����3H2O��
(3)���¶ȵ���1050Kʱ���¶Ƚϵͣ���ѧ��Ӧ���ʽ�������Ӧû�дﵽƽ�⣬ƽ��������Ӧ��Ӧ�ƶ��������¶����ߣ���ѧ��Ӧ��������NO��ת��������ƽ��ʱ��NO��ת��Ϊ80%������ͨ��NO�����ʵ���Ϊxmol����������ʽ���У�
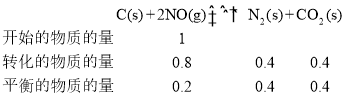
��CO2���������Ϊ![]() ��
��
����NO����ʼ���ʵ���Ϊ1mol�����跴Ӧ�ں㶨�¶Ⱥͱ�ѹǿ�½��У�NO��ƽ��ת����Ϊ������������ʽ���У�
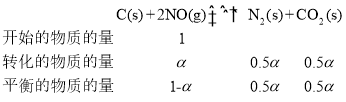
NO�����ʵ�������Ϊ![]() ��ͬ��N2��CO2����������ֱ�Ϊ0.5����0.5������
��ͬ��N2��CO2����������ֱ�Ϊ0.5����0.5������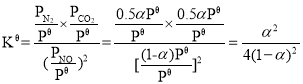 ��
��
(4)����Ͳ�У����ԽС��ѹǿԽ������ѹǿ��ƽ�������ƶ���
�����ԽС�������ʵ�Ũ��Խ��Ӧ����Խ��B���ѹǿ��E���ѹǿС����ôB������ʵ�Ũ�ȴ�ѧ��Ӧ���ʿ죬����vB>vE��
��ƽ����Է�������![]() �����������غ㣬������m���䣬��nԽС��ƽ����Է�������Խ��Ӧ������Ӧ������У�n���С����Ӧ������е�Խ�࣬ƽ����Է�������Խ��E�㵽F��Ĺ���Ϊѹ������Ĺ��̣�ѹǿ˲ʱ���F��HΪѹ�������ƽ�������ƶ��Ĺ��̣�H�ﵽƽ�⣬��H�㣬���ʵ������ʵ���n��С��ƽ��Ħ���������
�����������غ㣬������m���䣬��nԽС��ƽ����Է�������Խ��Ӧ������Ӧ������У�n���С����Ӧ������е�Խ�࣬ƽ����Է�������Խ��E�㵽F��Ĺ���Ϊѹ������Ĺ��̣�ѹǿ˲ʱ���F��HΪѹ�������ƽ�������ƶ��Ĺ��̣�H�ﵽƽ�⣬��H�㣬���ʵ������ʵ���n��С��ƽ��Ħ���������


 ѧ�����νӽ̲��Ͼ���ѧ������ϵ�д�
ѧ�����νӽ̲��Ͼ���ѧ������ϵ�д� Сѧ������ҵϵ�д�
Сѧ������ҵϵ�д� ��ʿһ��ȫͨϵ�д�
��ʿһ��ȫͨϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������MnO2��Ũ������ȡ����ʱ����14.6 g�Ȼ��ⱻ����������Cl2ȫ����ʯ��ˮ���գ����Ƶ�Ư�۵�������
A. 14.3 g B. 25.4 g C. 28.6 g D. 50.8 g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������(![]() ��
��![]() )����������±�ص��ʡ���2.335g��������ȫ�ֽ⣬����0.01molҺ���Һ�224mL(��״����)����ɫ�ĵ������������ش�
)����������±�ص��ʡ���2.335g��������ȫ�ֽ⣬����0.01molҺ���Һ�224mL(��״����)����ɫ�ĵ������������ش�
(1)��������ȫ�ֽ�Ļ�ѧ����ʽ��________��
(2)����ˮ��Ӧ�����ӷ���ʽ��_________��
(3)�����йػ�������ҵ�˵����ȷ����________��(����ĸ)
A.�ײ������ȼ�����һ����
B.һ����������������ϩ��Ӧ
C.�����и�ԭ�Ӿ��ﵽ8�����ȶ��ṹ
D.�ֵ��г������ң���ֱ���������������ᴿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̫��ˮ�����װ����ͼ��ʾ���õ���������缫��ɣ�����aΪTiO2�缫��bΪPt�缫��cΪWO3�缫���������ҺΪpH=3��Li2SO4-H2SO4��Һ������ӽ���Ĥ����ط�ΪA��B��������A����� ����ͨ��B��Ϊ�����ϵ����N2���������й��ڸõ�ص�˵��������ǣ� ��
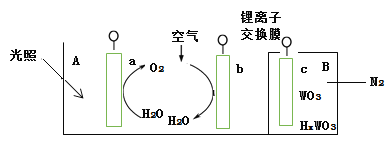
A.���õ�������a��c,��aΪ�������õ缫����pH��С
B.���õ�������a��c,��c�缫�ĵ缫��ӦʽΪHxWO3 - xe- =WO3 + xH+
C.���õ���������a��c,������b��c,��ʵ��̫���������ת��
D.���õ�������b��c, b�缫�ĵ缫��ӦʽΪO2+4H++4e-=2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ��ֻ���д������������ӣ�Fe3+��NO3����K+��M���ӣ����ⶨFe3+��NO3����K+��M���ӵ����ʵ���֮��Ϊ2:5:1:1����M���ӿ�����
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� ��
A.����ı��������Ƕ����ЧӦ
B.��ɫ��Ӧ��Ԫ�ص����ʣ����ڻ�ѧ�仯
C.�ܶ�Ϊ1.84g/ml��98%�����ᣬ�����ʵ���Ũ��Ϊ1.84mol/L
D.NA��HCl���ӵ��������Կ�Ϊ��λ��������Է�����������ֵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩͪ��CH2=C=O����һ���������ܸ���������ԭ�ӵĻ�������ӳɷ�Ӧ����Ӧ��ͨʽ�ɱ�ʾΪCH2=C=O+HA=C=O+HA��![]() (�����ȶ�)��
(�����ȶ�)��![]() ��ָ�����з�Ӧ���������ǣ��� ��
��ָ�����з�Ӧ���������ǣ��� ��
A. CH2=C=O+HCl![]() CH3COCl
CH3COCl
B. CH2=C=O+H2O![]() CH3COOH
CH3COOH
C. CH2=C=O+CH3CH2OH![]() CH3COCH2CH2OH
CH3COCH2CH2OH
D. CH2=C=O+CH3COOH![]() �� CH3 C O��2O
�� CH3 C O��2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з���ʽ��д����ȷ����( )
A. ��ϩʹ������Ȼ�̼��Һ��ɫ�� Br2+ CH2=CH2�� CH2BrCH2Br
B. �ö��Ե缫����Ȼ�����Һ�� 2Cl -+ 2H2O![]() H2+Cl2��+ 2OH-
H2+Cl2��+ 2OH-
C. ʵ��������Ȳ�� CaC2 + 2H2O �� C2H2�� + Ca(OH)2
D. ������������������Һ���ȣ� BrCH2COOH+OH-![]() BrCH2COO-+H2O
BrCH2COO-+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڢ١��ڡ����ݻ����ȵĺ����ܱ������У�������0.1molCO��0.2molH2���ڴ����������·�����Ӧ��CO(g)+2H2(g)![]() CH3OH(g)���������������ƽ��������CH3OH������������¶ȵı仯��ͼ��ʾ������˵����ȷ���ǣ� ��
CH3OH(g)���������������ƽ��������CH3OH������������¶ȵı仯��ͼ��ʾ������˵����ȷ���ǣ� ��
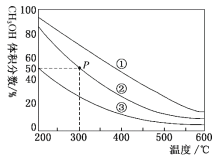
A.�÷�Ӧ������ӦΪ���ȷ�Ӧ
B.���������ݻ�����>��>��
C.��P�㣬COת����Ϊ75%
D.��P�㣬�����������ٳ���CO��H2��CH3OH��0.025mol����ʱv(CO)��>v(CO)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com