
【题目】下列方程式书写不正确的是( )
A. 乙烯使溴的四氯化碳溶液褪色: Br2+ CH2=CH2→ CH2BrCH2Br
B. 用惰性电极电解氯化钠溶液: 2Cl -+ 2H2O![]() H2+Cl2↑+ 2OH-
H2+Cl2↑+ 2OH-
C. 实验室制乙炔: CaC2 + 2H2O → C2H2↑ + Ca(OH)2
D. 溴乙酸与氢氧化钠溶液共热: BrCH2COOH+OH-![]() BrCH2COO-+H2O
BrCH2COO-+H2O
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】当实验出现某种现象时,即可判定该步实验操作已完成。下列实验中出现结束该步操作的现象正确的是
A.“镀锌铁皮锌镀层厚度的测定”:铁皮在稀硫酸溶液中不再产生气泡
B.“食醋总酸含量的测定”:滴入NaOH标准溶液,锥形瓶内溶液恰好呈浅红色
C.“乙酸乙酯碱性条件下水解”:NaOH溶液上层的油层消失
D.“硫酸亚铁铵的制备”:蒸发![]() 和
和![]() 混合溶液,出现大量晶体
混合溶液,出现大量晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素的化合物种类繁多,性质也各不相同。请回答下列问题:
(1)NO2有较强的氧化性,能将SO2氧化成SO3,自身被还原为NO,已知下列两反应过程中能量变化如图1、图2所示,则NO2氧化SO2生成SO3(g)的热化学方程式为____。
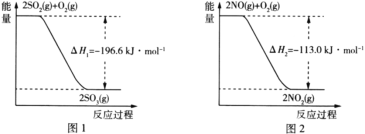
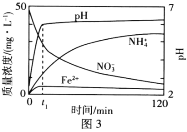
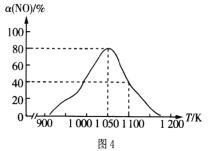
(2)在氮气保护下,在实验室中用足量的Fe粉还原KNO3溶液(pH =2.5)。反应过程中溶液中相关离子的质量浓度、pH随时间的变化曲线(部分副反应产物曲线略去)如图3所示。请根据图3中信息写出![]() min前反应的离子方程式____。
min前反应的离子方程式____。
(3)研究人员用活性炭对汽车尾气中的NO进行吸附,发生反应C(s) +2NO(g)![]() N2(g) +CO2(g)
N2(g) +CO2(g) ![]() H<0。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,反应相同时间时,测得NO的转化率
H<0。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,反应相同时间时,测得NO的转化率![]() (NO)随温度的变化如图4所示:
(NO)随温度的变化如图4所示:
①由图4可知,温度低于1 050 K时,NO的转化率随温度升高而增大,原因是__;温度为1050 K时CO2的平衡体积分数为__。
②对于反应C(s) +2NO(g)![]() N2(g)+CO2(g)的反应体系,标准平衡常数
N2(g)+CO2(g)的反应体系,标准平衡常数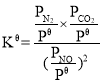 ,其中
,其中![]() 为标准压强(1×105Pa),
为标准压强(1×105Pa),![]() 、
、![]() 和
和![]() 为各组分的平衡分压,如
为各组分的平衡分压,如![]() =
=![]() ·
·![]() ,
,![]() 为平衡总压,
为平衡总压,![]() 为平衡系统中 NO的物质的量分数。若NO的起始物质的量为1 mol,假设反应在恒定温度和标准压强下进行,NO的平衡转化率为
为平衡系统中 NO的物质的量分数。若NO的起始物质的量为1 mol,假设反应在恒定温度和标准压强下进行,NO的平衡转化率为![]() ,则
,则![]() =__(用含
=__(用含![]() 的最简式表示)。
的最简式表示)。
(4)利用现代手持技术传感器探究压强对2NO2 (g)![]() N2O4(g)平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在
N2O4(g)平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在![]() s、
s、![]() s时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图5所示。
s时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图5所示。
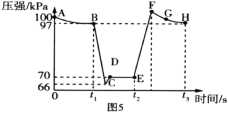
①B、E两点对应的正反应速率大小为![]() __(填“ > ”“ < ”或“ =”)
__(填“ > ”“ < ”或“ =”)![]() 。
。
②E、F、G、H四点对应气体的平均相对分子质量最大的点为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,Cl-的物质的量浓度最大的是( )
A.75mL4mol/L的KClO3溶液
B.50mLAl3+浓度为1mol/L的AlCl3溶液
C.9.5gMgCl2溶于水所配得的100mL溶液
D.1L密度为1.1g/cm3、质量分数为3.65%的HCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意计算填空。
(1)在标准状况下,8.5g某气体占有的体积为5.6L,则该气体的摩尔质量是__。
(2)在标准状况下,0.01mol某气体的质量为0.28g,则该气体的相对分子质量为__,该气体的密度为__g·L1。
(3)在标准状况下,由CO和CO2组成的混合气体为6.72L,质量为12g,此混合物中CO和CO2物质的量之比是__,C和O原子个数比是__,CO的质量分数是__。
(4)现有mg某气体,它由双原子分子构成,它的相对分子质量为M。若阿伏伽德罗常数用NA表示,则:该气体的物质的量为__mol;该气体所含原子总数为__个;该气体在标准状况下的体积为__L;该气体溶于水后形成1L溶液(该气体不与水反应),其物质的量浓度为__mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.10 mol·L-1的NaOH溶液,整个过程中溶液pH变化的曲线如图所示。下列叙述中正确的是

A. 点①所示溶液中:c(H+)=c(Cl-)+c(HClO)+c(OH-)
B. 点②所示溶液中:c(H+)>c(Cl-)>c(ClO—)>c(HClO)
C. 点③所示溶液中:c(Na+)=2c(ClO-)+c(HClO)
D. 点④所示溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(HClO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:

供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作①的名称是________,操作②的名称是____________。
(2)试剂a是____________(填化学式,下同),试剂b是__________,固体B是____________。
(3)加入试剂a所发生反应的化学方程式为__________________________________。
加入试剂b所发生反应的化学方程式为____________________________________。
(4)该方案能否达到实验目的:__________________________(填“能”或“不能”)。若不能,应如何改进?(若能,此问不用回答)__________。
(5)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是____的质量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.我国的青海省有许多盐湖盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用。粗盐中含Ca2+、Mg2+、SO42-以及泥沙等杂质,为了除去可溶性杂质,有以下实验步骤进行提纯:
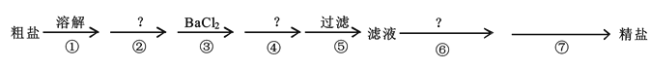
(1)④步所加试剂是____。
(2)第⑥步发生反应的离子方程式为____、____。
(3)第⑦步的操作名称____,需要的玻璃仪器有____、____。
(4)通过步骤⑤中过滤后的滤液,检验SO42-已除尽的操作方法是____。
Ⅱ.(1)设阿伏加德罗常数为NA,标准状况下,某O2和N2的混合气体m g含有b个分子,则n g该混合气体在相同状况下所占的体积是____L。
(2)在xR2++yH++O2═mR3++nH2O的离子方程式中,对化学计量数m和R2+、R3+判断正确的是____。
A.m=y,R3+是氧化产物 B.m=2y,R2+被氧化
C.m=2,R3+是氧化剂 D.m=4,R2+是还原剂
(3)用双线桥法标出下列反应的电子转移方向和数目____。2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是一些烷烃的燃烧热,则下列表达正确的是
化合物 | 燃烧热/ kJ·mol-1 | 化合物 | 燃烧热/ kJ·mol-1 |
甲烷 | 891.0 | 正丁烷 | 2878.0 |
乙烷 | 1560.8 | 异丁烷 | 2869.6 |
丙烷 | 2221.5 | 异戊烷 | 3531.3 |
A. 正戊烷的燃烧热大于3531.3 kJ·mol-1
B. 相同质量的烷烃、碳的质量分数越大,燃烧放出的热量越多
C. 正丁烷转化为异丁烷的热化学方程式为:CH3CH2CH2CH3(g) ![]() CH3CH(CH3)CH3(g) △H =+8.4kJ·mol-1
CH3CH(CH3)CH3(g) △H =+8.4kJ·mol-1
D. 甲烷燃烧的热化学方程式为:CH4(g)+2O2(g) ![]() CO2(g) +2H2O(g) △H =-891.0kJ·mol-1
CO2(g) +2H2O(g) △H =-891.0kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com