
| 一定条件 |
| 时间/min | 0 | 30 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
| 总质量 |
| 体积 |
| 总质量 |
| 总物质的量 |
| 0.03 |
| 0.02×0.14×0.14 |
| 22.4L |
| 22.4L/mol |
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、1 | B、2 | C、3 | D、4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,其中A为地壳中含量最高的金属元素.
短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,其中A为地壳中含量最高的金属元素.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 硫的氧化物、氮的氧化物和一氧化碳是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.
硫的氧化物、氮的氧化物和一氧化碳是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.| 1 |
| 2 |
| n(H2) |
| n(CH3OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
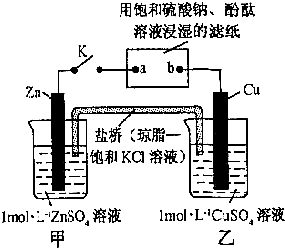
| A、Cu电极上发生还原反应 |
| B、电子沿Zn→a→b→Cu路径流动 |
| C、片刻后盐桥中Cl-向左移动 |
| D、片刻后可观察到滤纸a点变红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com