
��10�֣�Ϊ�˲ⶨ���ᾧ�壨H2C2O4��xH2O���е�xֵ����������ʵ��
��1����ȡWg���ᾧ�壬���100.00mL��Һ
��2��ȡ25.00mL������Һ����ƿ�ڣ���������ϡH2SO4����Ũ��Ϊamol/L��KMnO4��Һ�ζ���KMnO4������ɫΪֹ���������ķ�ӦΪ�� 2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2��+2MnSO4+8H2O��
�Իش�
��ʵ���У���Ҫ�������У�����ţ� ����ȱ�ٵ������У������ƣ�
A������ƽ�������롢���ӣ� B�ζ��� C 100mL����Ͳ D��100mL������ƿ
E���ձ� F��©�� G����ƿ H�������� I��ҩ�� J����ƿ
��ʵ���У���KMnO4��ҺӦװ�� ʽ�ζ����У���Ϊ
�����ڽӽ��ζ��յ�ʱ������������ˮ����ƿ�ڱڳ�ϴһ�£��ټ��������յ㣬������õ�x��ֵ�� ����ƫ��ƫС����Ӱ�죩��
���ڵζ�����������ȥamol/L��KMnO4��ҺVmL���������ƵIJ�����Һ�����ʵ���Ũ��Ϊ mol/L���ɴˣ�x= ��
�����ζ��յ����ʱ���ӿ̶ȣ�������xֵ�� ����ƫ��ƫС����Ӱ�죩��
��A��B��D��E��G��H��I ����ͷ�ιܡ�����̨���ζ��ܼ� ��
���� ��KMnO4��Һ�и�ʴ�ԣ��ḯʴ������Ӱ��
��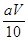 �� x=
�� x=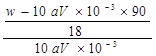 ����
����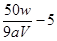 ���� ƫ�� ��
���� ƫ�� ��
��������������ٸ���������Һ��Ҫ��������֪���ڸ�ʵ���У���Ҫ��������A��B��D��E��G��H��I ����ȱ�ٵ������н�ͷ�ιܡ�����̨���ζ��ܼУ���ʵ���У���KMnO4��Һ��Ϊ��ǿ�����ԣ��ḯʴ�ܣ�����Ӧ��Ӧװ����ʽ�ζ����У������ڽӽ��ζ��յ�ʱ������������ˮ����ƿ�ڱڳ�ϴһ�£��ټ��������յ㣬��Ϊ��ƿ�����ʵ������ȶ�û�б仯������������õ�x��ֵ�����κ�Ӱ�죻�ܸ��ݷ�Ӧ����ʽ2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2��+2MnSO4+8H2O��֪��n(H2C2O4)= 5/2n(KMnO4) ��n(KMnO4)= aV��10-3mol��0.025L��c(H2C2O4)= 5/2��aV��10-3�����c(H2C2O4)=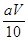 mol/L����[Wg��(90+18x)g/mol]��4=
mol/L����[Wg��(90+18x)g/mol]��4=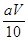 ��0.025mol,���x=
��0.025mol,���x=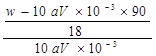 ����
����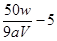 �������ζ��յ����ʱ���ӿ̶ȣ����������ʵ���ƫ�٣������xֵ��ƫ��
�������ζ��յ����ʱ���ӿ̶ȣ����������ʵ���ƫ�٣������xֵ��ƫ��
���㣺�������ʵ���Ũ�ȵ���Һ�����ơ��ζ����ڲⶨ���ʵ�Ũ�Ȼ���������е�Ӧ�õ�֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
������ܱ�װ���У��������ƣ�NaClO2��������һ�������·����ֽⷴӦ���������γɵIJ�����
| A��NaCl��O2 | B��NaClO3��NaClO | C��NaClO3��Cl2 | D��NaClO3��NaCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��ijFeBr2��Һ�У�ͨ��1.12L����״������Cl2�������Һ��c(Br-)=3c(Cl-)=0.3mol/L����Ӧ��������Һ������仯���ơ�������˵������ȷ����
| A��ԭ��Һ��Ũ��Ϊ0.1mol/L |
| B����Ӧ����Һ��c(Fe3+)=0.1mol/L |
| C����Ӧ����Һ��c(Fe3+)=c(Fe2+) |
| D��ԭ��Һ��c��Br-��=0.4mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�Ӻ�ˮ�п�����ȡ�壬��Ҫ��ӦΪ��2Br����Cl2===2Cl����Br2������˵����ȷ����(����)
| A�������Ӿ��������� | B�������ǻ�ԭ�� |
| C���÷�Ӧ���ڸ��ֽⷴӦ | D�������������Ա��嵥��ǿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��6�֣�1.52gͭþ�Ͻ���ȫ�ܽ���50mL�ܶ�Ϊ1.40g��mL-1����������Ϊ63%��Ũ�����У��õ�NO2��N2O4�Ļ������1120mL(��״��)����Ӧ�����Һ�м���1.0mol��L-1NaOH��Һ������������ȫ������ʱ���õ�2.54g������
��1���úϽ���ͭ��þ�����ʵ���֮���� ��
��2��NO2��N2O4�Ļ�������У�NO2����������� ��
��3���õ�2.54 g����ʱ������NaOH��Һ������� mL��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ijϡ���������Ļ����Һ200 mL���ֳ����ݡ�������һ������ͭ�ۣ�������ܽ�19.2 g����֪����ֻ����ԭΪNO��������һ���������ۣ�������������������������ӵı仯��������ͼ��ʾ��
��1���ڶ�����Һ����������Ϊ ��
��2��OA�β����������� ���ѧʽ����BC�β����������� ���ѧʽ����AB�εķ�ӦΪ ��
��3��ԭ�������HNO3�����ʵ���Ϊ mol��H2SO4�����ʵ���Ũ��ӦΪ mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��13�֣���ѧ�ڻ�������������ʮ����Ҫ�����á������������͵绯ѧ���ⷨ����������ˮ�������ε���Ⱦ��
��1�������������У�H2�ܽ�NO ��ԭΪN2��25��ʱ����Ӧ����10 min����Һ��pH��7��Ϊ12�������£���
��ԭΪN2��25��ʱ����Ӧ����10 min����Һ��pH��7��Ϊ12�������£���
�� ��֪��pH=-lgc(H+),�����£�ˮ��Һ��c(H+)��c(OH-)=10-14 ��
��N2�ĽṹʽΪ________��
���벹�����ӷ���ʽ����������ƽ��������Ӧ���ӷ���ʽΪ(��ƽΪ1��ʡ��)
�� ��NO ���� ��H2���� �� ��N2���� ��H2O���� ��__________��
���� ��H2���� �� ��N2���� ��H2O���� ��__________��
��ƽ����Ӧ����v(NO )= mol��L��1��min��1��
)= mol��L��1��min��1��
��2���绯ѧ����NO ��ԭ����ͼ��ʾ��
��ԭ����ͼ��ʾ��
�ٵ�Դ����Ϊ________(�A����B��)��
������ӦʽΪ ��
������������ת����2 mol���ӣ���Ĥ������Һ�������仯��(��m������m��)Ϊ________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��16�֣���2012?ɽ����ƫ��������N2O4�dz��õĻ���ƽ��������߷������»�ѧ��Ӧ��
��CH3��2NNH2��l��+2N2O4��l���T2CO2��g��+3N2��g��+4H2O��g��������
��1����Ӧ���������������� ����
��2������к��г��ֺ���ɫ���壬ԭ��Ϊ��N2O4��g��?2NO2��g��������
���¶�����ʱ��������ɫ�����Ӧ����Ϊ�� ��������ȡ����ȡ�����Ӧ��
��3��һ���¶��£���Ӧ�����ʱ�Ϊ��H���ֽ�1mol N2O4����һ��ѹ�ܱ������У�����ʾ��ͼ��ȷ����˵����Ӧ�ﵽƽ��״̬������ ����������ͬ�¶��£�������Ӧ�������Ϊ1L�ĺ����ܱ������н��У�ƽ�ⳣ���� ������������䡱��С��������Ӧ3s��NO2�����ʵ���Ϊ0.6mol����0��3s�ڵ�ƽ����Ӧ����v��N2O4��=�� �� mol/��L?s����1��
��4��NO2���ð�ˮ��������NH4NO3��25��ʱ����a mol NH4NO3����ˮ����Һ�����ԣ�ԭ���� ���������ӷ���ʽ��ʾ���������Һ�μ�b L ��ˮ����Һ�����ԣ���μӰ�ˮ�Ĺ�����ˮ�ĵ���ƽ�⽫�� ��������������������ƶ������μӰ�ˮ��Ũ��Ϊ mol?L��1����NH3?H2O�ĵ���ƽ�ⳣ��ȡKb=2��10��5 mol?L��1��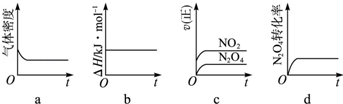
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
������ԭ��Ӧ��������������Ӧ�ù㷺������KMnO4��H2O2��Fe��NO3��3����Ҫ��������������ѧ֪ʶ�ش����⣺
��1����ϡ�����У�KMnO4�ܽ�H2C2O4����ΪCO2���÷�Ӧ�Ļ�ѧ����ʽΪ ����Ӧ������1mol��MnO4��ʱת�Ƶ�����Ϊ ��
��2��ȡ300mL 0��2mol/L��KI��Һ��һ����������KMnO4��Һǡ�÷�Ӧ�����ɵ����ʵ�����I2��KIO3��������KMnO4�����ʵ������� mol��
��3����Fe��NO3��3��Һ�м���Na2SO3��Һ����Һ�����ػ�ɫ��Ϊdz��ɫ����һ���ֱ�Ϊ�ػ�ɫ����Һ�ȱ�Ϊdz��ɫ�����ӷ���ʽ�� ���ֱ�Ϊ�ػ�ɫ��ԭ���� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com