
【题目】下列离子方程式正确的是
A. 向小苏打溶液中加入足量澄清石灰水:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O
B. 向醋酸钠溶液中通入少量的二氧化碳:2CH3COO- + CO2 + H2O=2CH3COOH+CO![]()
C. 向溴化亚铁溶液通入过量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
D. 向氢氧化钡溶液中加入硫酸氢钠溶液至恰好完全沉淀:Ba2+ +OH-+H++SO42- =BaSO4↓+H2O
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】氨是最重要的氮肥,是产量最大的化工产品之一.德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,他因此获得了1918年诺贝尔化学奖.在密闭容器中,将2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g)
2NH3(g) ΔH=-92.4 kJ·mol-1,他因此获得了1918年诺贝尔化学奖.在密闭容器中,将2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ·mol-1。
2NH3(g) ΔH=-92.4 kJ·mol-1。
(1)当反应达到平衡时,N2和H2的浓度比是____;N2和H2的转化率比是____.反应放出的热量___(填“大于”“小于”或“等于”)184.8 kJ。
(2)降低平衡体系的温度(保持体积不变),混合气体的平均相对分子质量____,密度____.平衡常数K_________(填“增大”“减小”或“不变”).
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将_____(填“正向”“逆向”或“不”)移动.
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将_____(填“向左移动”“向右移动”或“不移动”).达到新平衡后,容器内温度_____(填“大于”“小于”或“等于”)原来的2倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积为1.0 L的恒容密闭容器中发生反应:2CH3OH(g)![]() CH3OCH3(g)+H2O(g) 下列说法正确的是
CH3OCH3(g)+H2O(g) 下列说法正确的是
编号 | 温度 | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
Ⅰ | 387℃ | 0.20 | 0.080 | 0.080 |
Ⅱ | 387℃ | 0.40 | ||
Ⅲ | 207℃ | 0.20 | 0.090 | 0.090 |
A. 该反应的正反应为吸热反应
B. 达到平衡时,容器Ⅰ中的CH3OH体积分数比容器Ⅱ中的小
C. 容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的长
D. 若起始时向容器Ⅰ中充入CH3OH 0.15 mol、CH3OCH3 0.15 mol和H2O 0.10 mol,则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)已知下列反应的反应热为:①CH3COOH(l)+2O2(g)= 2CO2(g)+2H2O(l) △H1= - 870.3 kJ mol-1
②C(s)+O2(g) = CO2(g) △H= -393.5 kJ mol-1
③H2(g)+![]() O2(g) = H2O(l) △H= - 285.8 kJ mol-1
O2(g) = H2O(l) △H= - 285.8 kJ mol-1
试计算下列反应的反应热:2C(s)+2H2(g)+O2(g) =CH3COOH(l) △H= _____________。
(2) 已知:2Al (s)+![]() O2(g)= Al2O3(s) △H= -1644.3 kJ mol-1
O2(g)= Al2O3(s) △H= -1644.3 kJ mol-1
2Fe (s) +![]() O2(g)= Fe2O3(s) △H= -815.88 kJ mol-1
O2(g)= Fe2O3(s) △H= -815.88 kJ mol-1
试写出铝粉与氧化铁粉末发生铝热反应的热化学方程式___________________________。
(3)大气中的部分碘源于O3对海水中Ⅰ-的氧化。将O3持续通入NaI溶液中进行模拟研究 O3将I — 氧化成I2 的过程由3步反应组成: ① I —(aq)+ O3(g)= ⅠO—(aq)+O2(g) △H1
②ⅠO—(aq)+ H+(aq) ![]() HOI (aq) △H2
HOI (aq) △H2
③ HIO(aq) + I—(aq) + H+(aq) ![]() I2(aq) + H2O(l) △H3
I2(aq) + H2O(l) △H3
总反应的离子方程式为_______________________________ ,反应热为 _______________(用含△H1、△H2、△H3 的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某古玩爱好者收藏的“商代铝碗”在“鉴宝”时被专家当场否定,其理由是( )
A.铝的性质较活泼,难提炼,商代不可能有铝制品
B.铝的质地较软,易变形,不宜做碗
C.铝元素易导致老年痴呆,不宜盛放食物
D.铝的导热性较强,不宜做碗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列做法符合“绿色化学”思想的是( )
A. 回收利用废旧电池
B. 用燃气热水器代替太阳能热水器
C. 将实验室的有机废液直接倒入下水道
D. 在通风橱中制取SO2不用NaOH溶液吸收尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如图所示:
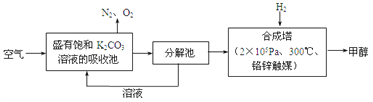
(1)分解池中主要物质是_______________。
(2)在合成塔中,若有4400 g CO2与足量H2完全反应,生成气态的H2O和气态甲醇,可放出5370 kJ的热量,写出该反应的热化学方程式_______________。
(3)一定条件下,往2L恒容密闭容器中充入1 mol CO2和3 mol H2,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内CO2的转化率随温度变化如下图所示:
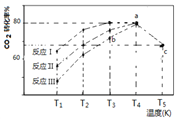
(图中c点的转化率为66.67%,即转化了2/3)
①催化剂效果最佳的反应是________(填“反应I”,“反应II”,“反应III”)。
②b点v (正)_________v (逆)(填 “>”, “<”, “=”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是____________。
④c点时该反应的平衡常数K =____________________。
(4)科学家还研究了其它转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为_______________。
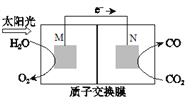
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2和H2S会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,回答下列方法中的问题。
(1)用氨水除去SO2:
已知 25℃,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8,NH3·H2O的 Kb=1.8×l0-5。
①试写出H2SO3在水溶液中的电离方程式__________________,从电离平衡的角度解释Ka1、Ka2差别很大的原因_________________。
②若氨水的浓度为0.02 mol·L-1,溶液中的c(OH-)=____________mol·L-1、将SO2通入该氨水中,当溶液中的c(SO32-)/ c(HSO3-)=6.2时,溶液的pH=_____________。
(2)生物脱H2S:
原理为:H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4=2Fe2(SO4)3+2H2O
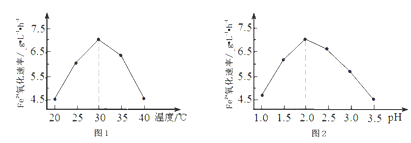
①硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是_______________ 。
②由图1和图2判断使用硫杆菌的最佳条件为________________ ,若反应温度过高,反应速率下降,其原因是__________________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com