
【题目】合成氨反应过程中的能量变化如图所示,下列说法正确的是

A. 反应体系中加入催化剂,会改变反应的热效应
B. 反应物的总能量低于生成物的总能量
C. 该反应的热化学方程式为3H2(g)+N2(g)![]() 2NH3(g)△H=-QkJ/mol(Q>0)
2NH3(g)△H=-QkJ/mol(Q>0)
D. 该反应是吸热反应
 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、F五种物质的焰色反应均为黄色,A、B、C、D与盐酸反应均生成E,此外B还生成一种可燃气体。而C、D还生成一种无色无味气体H,该气体能使澄清石灰水变浑浊。D和A可反应生成C,F和H也可反应生成C和另一种无色无味气体。
请回答下列问题:
(1)写出A、B、C、D、E、F的化学式
A________;B________;C________;D________;E________;F________。
(2)写出F和H反应的化学方程式 __________________________________。
(3)写出下列反应的离子方程式:
①D+盐酸 ________________________________________________;
②B+水 _____________________________________________________;
③D+A ______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种特殊的热激活电池示意图如下。该电池总反应为:PbSO4(s)+2LiCl+Ca(s)= CaCl2(s)+ Li2SO4+Pb(s) ,下列说法不正确的是

A. Ca电极发生氧化反应
B. 负极的电极反应:Ca(s)+2Cl﹣﹣2e﹣= CaCl2(s)
C. 可用 LiCl 和 KCl 水溶液代替无水 LiCl﹣KCl
D. 当无水LiCl﹣KCl混合物受热熔融后电池才能工作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素T、X、Y、Z、W在元素周期表中的相对位置如下表所示,其中T的单质在一定条件下能与W的最高价氧化物对应水化物的浓溶液反应并生成两种酸性气体,则下列相关说法正确的是

A. 离子半径:X<Y<W
B. 最简单气态氢化物的热稳定性:W<Z
C. ![]() 分子中每个原子均满足8电子稳定结构
分子中每个原子均满足8电子稳定结构
D. 最高价氧化物对应水化物的碱性:X<Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是一种重要化工原料。
(1)德国化学家哈伯从1902年开始研究由氮气和氢气直接合成氨。
已知:①![]() △H=a kJ/mol
△H=a kJ/mol
②每破坏lmol有关化学键需要的能量如下表:
H-H | N-H | N≡N |
436kJ | 391kJ | 946k |
则a=_________________。
(2)下图为不同温度(T)、不同投料比[n(![]() )/n(
)/n(![]() )]时反应达到平衡时
)]时反应达到平衡时![]() 的转化率变化曲线。
的转化率变化曲线。

①![]() 、
、![]() 、
、![]() 、
、![]() 的大小关系为__________________。
的大小关系为__________________。
②保持温度和体积不变,提高投料比[n(![]() )/n(
)/n(![]() )],则重新达到平衡时,下列说法一定正确的是_______(填字母序号)。
)],则重新达到平衡时,下列说法一定正确的是_______(填字母序号)。
A.![]() 的浓度增大
的浓度增大
B.![]() 的转化率增大
的转化率增大
C.![]() 的体积分数增大
的体积分数增大
D.![]() 的浓度减小
的浓度减小
③温度为![]() 时,向2L密闭容器中加入1.0mol
时,向2L密闭容器中加入1.0mol![]() 和1.0mol
和1.0mol![]() ,若5min后反应达到平衡,则用v(
,若5min后反应达到平衡,则用v(![]() )表示该反应的平均速率为____________________;反应在
)表示该反应的平均速率为____________________;反应在![]() 时的平衡常数K=________________。
时的平衡常数K=________________。
(3)一种新型除烟气中氮氧化物的方法是采用![]() 作还原剂还原烟气中的氮氧化物且产物无污染,写出
作还原剂还原烟气中的氮氧化物且产物无污染,写出![]() 还原
还原![]() 的化学反应方程式_____________________________________。
的化学反应方程式_____________________________________。
(4)若用标准盐酸测定某稀氨水的浓度,应选择__________作指示剂;滴定过程中眼睛注视_____________。已知稀氨水体积为25.0mL,滴定结束测得消耗0.0100mol/L盐酸的平均体积为20.0mL,则该氨水的浓度为________________(保留2位有效数字);若滴定前滴定管尖嘴有气泡,滴定后尖嘴无气泡,则测定结果________(填“偏大”、“偏小”、“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是( )

A. 升高温度,可能引起由c向b的变化
B. 该温度下,水的离子积常数为l.0×10-13
C. 该温度下,加入FeCl3可能引起由b向a的变化
D. 该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤及工业废气中的SO2是形成酸雨的主要原因,消除SO2是减少酸雨形成的有效方法。完成下列问题:
(1)已知:4FeS2(s)+11O2(g)═2Fe2O3(s)+8SO2(g)△H=﹣3412.0kJmol﹣1
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=﹣25.0 kJmol﹣1
2C(s)+O2(g)═2CO(g)△H=﹣221.0 kJmol﹣1
则2FeS2(s)+7O2(g)+3C(s)═2Fe(s)+3CO2(g)+4SO2(g)△H=_____kJmol﹣1。
(2)碱性NaClO2溶液脱硫法
SO2与碱性NaClO2溶液反应的离子方程式为2SO2+ClO2﹣+4OH﹣2SO42﹣+C1﹣+2H2O,已知pc=﹣lgc(SO2)。在刚性容器中,将含SO2的废气通入碱性NaClO2溶液中,测得pc与温度的关系如图所示。
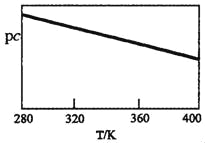
由图分析可知,该脱硫反应是_____反应(填“放热”或“吸热”);若温度不变,增大压强,该脱硫反应的平衡常数K_____(填“增大”、“减小”或“不变”)。
(3)燃料细菌脱硫法
①含FeS2的燃煤可用氧化亚铁硫杆菌(T.f)、氧化亚铁微螺菌(L.f)、氧化硫硫杆菌(T.t)进行脱硫,其脱硫过程如图所示:
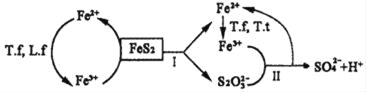
已知:脱硫总反应为:FeS2+14Fe3++8H2O═2SO42﹣+15Fe2++16H+,
Ⅰ反应的化学方程式为:FeS2+6Fe3++3H2O═S2O32﹣+7Fe2++6H+;
写出Ⅱ反应的化学方程式_____。
②在上述脱硫反应中,氧化亚铁硫杆菌(T.f)与Fe3+的形成过程可视为下图所示的原电池:

该细胞膜为_____(填“阳离子交换膜”或“阴离子交换膜”)。该电池的正极电极反应式为_____。该方法在高温下脱硫效率大大降低,原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeSO4是一种补血剂,常温下久置易变黄,一般认为是二价铁被氧化为三价铁的缘故。
(1)已知:①Fe2+(aq)-e-= Fe3+(aq) △H1=akJ/mol
②O2(g)+4 e-+4H+(aq)=2H2O(l) △H2=bkJ/mol
则FeSO4在酸性溶液中变质的热化学方程式为_____ 。
常温下,配制浓度为0.1mol/L的FeSO4溶液,研究不同 pH 对Fe2+ 氧化的影响,结果如下图所示,(假设反应过程中溶液体积不变)。

(2)在pH=5.5的环境下,该反应在0~15min的平均速率v(Fe2+)=_______;增大溶液pH,Fe2+被氧化速率_______(填“增大”、“减小”或“无影响”)。
(3)在平衡常数的计算中气态物质常以压强代替其浓度,Fe2+在酸性环境下氧化的平衡常数K的计算表达式是______;常温下该反应的平衡常数很大,为2.5×1032L4 /(atmmol4),下列说法正确的是_______。
a. Fe2+转化为Fe3+的趋势大 b. Fe2+转化为Fe3+的速率大
c. 反应进行得较为彻底 d. 酸性条件下Fe2+不会被氧化
(4)在pH=13的环境下,Fe2+的氧化变质可以理解为:
第一步: Fe2++2OH-= Fe(OH)2,第二步_____________ (用化学方程式回答);当氧化达到平衡时,c(Fe2+)/ c(Fe3+)_____4.0×1022(填“>”“<”或“=”)。已知的Ksp[Fe(OH)3]=2.5×10-39,Ksp[Fe(OH)2]=1.0×10-15。
(5)根据上述分析,配制FeSO4溶液的正确方法是加入适量的铁粉和_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的混合气体在密闭容器中发生反应 mA(g)+nB(g)![]() pC(g)达到平衡后,温度不变,将气体体积缩小到原来的1/3,达到平衡时,C的浓度为原来的2.5倍,则下列说法正确的是
pC(g)达到平衡后,温度不变,将气体体积缩小到原来的1/3,达到平衡时,C的浓度为原来的2.5倍,则下列说法正确的是
A. C的体积分数增加 B. A的转化率降低
C. 平衡向正反应方向移动 D. m+n>p
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com