
����Ŀ��Һ�ȴ����г�����NCl3����Һ����NCl3�����������ﵽ4%���Ͼ��б�ըΣ�ա�
(1)NCl3��ˮ������һ�ּ��������һ�־���Ư���Ե����ʡ�д���÷�Ӧ�Ļ�ѧ����ʽ________________________________________________��
(2)Ϊ�ⶨ�����е�NCl3��������һ������Ʒ��ͨ��������������NCl3(��ӦΪ��NCl3+4HCl��NH4Cl+3Cl2)������400 mL 20.0%(��=1.22g/cm3)�Ĺ�ҵNaOH��Һ�������е�Cl2��������պ�NaOH��Һ����51.4 g�����ⶨNCl3���չ���NH4+����Ϊ0.270 g��
��������ҵNaOH��Һ�����ʵ���Ũ��Ϊ____________��
�ڼ������Ʒ��NCl3���������������жϸ���Ʒ�Ƿ�ȫ��(д���������)____________��
���𰸡�NCl3+3H2O��NH3+3HClO 6.1mol/L n(NH4+)=0.015mol��m (NCl3)=1.8075g��ԭ����������Ϊ51.4-3.195=48.205 g��
NCl3%=3.61%������Ʒ��ȫ
��������
������֪��Ϣ�ƲⷴӦ���������֪�������Ƶ������������ܶȿɸ��ݹ�ʽ���ܶȣ���������������㷽����Һ����NCl3�����������ﵽ4%���Ͼ��б�ըΣ�ս��
(1)������Ϣ���Ʋ⣬NCl3����ˮ��Ӧ����һ�ּ������就����һ�־���Ư���Ե����ʴ����ᣬ�ʷ�Ӧ����ʽΪ��NCl3+3H2O��NH3+3HClO��
(2) ��20.0%����=1.22g/cm3���Ĺ�ҵNaOH��Һ����Ũ��Ϊ![]() ��
��
�ڲⶨNCl3���չ���NH4+����Ϊ0.270g��n��NH4+��=0.015mol���ɷ�Ӧ��֪��n��NCl3��=0.015mol����m��NCl3��=0.015mol��120.5g/mol=1.8075g�������ᴦ����������Ϊ0.015mol��3��71g/mol=3.195g��ԭ����������Ϊ51.4-3.195=48.205 g����![]() �������Ʒ��ȫ��
�������Ʒ��ȫ��


 ��ʦ������Ԫ��ĩ���100��ϵ�д�
��ʦ������Ԫ��ĩ���100��ϵ�д� ��У������Ԫͬ��ѵ��������ϵ�д�
��У������Ԫͬ��ѵ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.��ϵͳ��������������![]() ������Ϊ2��6��������5���һ�����
������Ϊ2��6��������5���һ�����
B.������CH3CH(NH2)COOH�ͱ�������C6H5-CH2-CH(NH2)COOH ��ˮ����������3�ֶ���
C.������ �DZ���ͬϵ��
�DZ���ͬϵ��
D.������������ķ���ʽΪC3H5N3O9
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼAװ�ó�����ʵ�����Ʊ�����
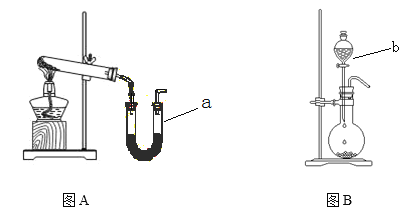
(1)д��ʵ�����ø�װ���Ʊ�O2��ѧ����ʽ __________________________________��
(2)�����ø�װ���Ʊ�����NH3���Թ��з���ҩƷ��_______________(�ѧʽ)������ a�з���ҩƷ������________ ��
(3)ͼBװ��ʵ���ҿ������Ʊ��������л�������_______������b������_________����ѧ������ͼBװ����Ũ��ˮ����ʯ���Ʊ�NH3����˵���÷�����ȡNH3��ԭ�� ��______________________________________________________________
(4)ѧ���װ�ͼ��ʾ̽����������
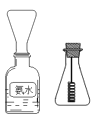
����һֻ��ƿ������Ũ��ˮ�Լ�ƿ���ռ����� ��Ȼ���ȵ�����״ͭ˿������ƿ�У�Ƭ�̣���ƿ�������Ϊ����ɫ������������ȷ����_________
A.��ͼ�ռ����������ð�ˮ���ܶȽ�С B.��ƿ�������
C.�ռ�����ʱ��Խ��������ɫ����Խ���� D.ͭ˿�ܱ��ֺ���
��ѧ���Ҷ�ѧ����ʵ����������飬��Ϊʵ���в����ĺ���ɫ��������ǿ����еĵ�����������ɵģ�����Ϊѧ���ҵ�˵���������������һ����ʵ��֤��ѧ���ҵ�˵���Ƿ���ȷ��_____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���1molA(g)��1molB(g)����2L�ܱ������з�����Ӧ����t1ʱ�ﵽƽ�⣺A(g)+ B(g)![]() xC(g)+D(s)����t2��t3ʱ�̷ֱ�ı䷴Ӧ��һ�����������������C(g)��Ũ����ʱ��仯��ͼ��ʾ���й�˵����ȷ����
xC(g)+D(s)����t2��t3ʱ�̷ֱ�ı䷴Ӧ��һ�����������������C(g)��Ũ����ʱ��仯��ͼ��ʾ���й�˵����ȷ����
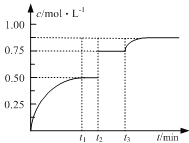
A.��Ӧ����ʽ��x��2
B.t2ʱ�̸ı��������ʹ�ô���
C.t3ʱ�̸ı����������ȥ����D
D.t1��t3��÷�Ӧ��ƽ�ⳣ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ٷɻ���ƽ�������ʱ��β���е�NO���ƻ������㡣��ѧ�������о����ô�������β���е�NO��COת���CO2��N2����ѧ����ʽ���£�2NO��2CO![]() 2CO2��N2��Ϊ�˲ⶨ��ij�ִ��������µķ�Ӧ���ʣ���ij�¶��������崫������ò�ͬʱ���NO��COŨ�������
2CO2��N2��Ϊ�˲ⶨ��ij�ִ��������µķ�Ӧ���ʣ���ij�¶��������崫������ò�ͬʱ���NO��COŨ�������
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(10��4mol��L��1) | 10 | 4.5 | 2.5 | 1.5 | 1.0 | 1.0 |
c(CO)/(10��3mol��L��1) | 36.0 | 30.5 | 28.5 | 27.5 | 27.0 | 27.0 |
��ش���������(���������¶ȱ仯�Դ�����Ч�ʵ�Ӱ��)��
(1) ��֪�÷�Ӧ��S<0�������������·�Ӧ�ܹ��Է����У���Ӧ�Ħ�H________0(��д��>����<������)��
(2)ǰ2 s�ڵ�ƽ����Ӧ����v(N2)��________��
(3)�ڸ��¶��£���Ӧ��ƽ�ⳣ������ʽK��________��
(4)�������ܱ������з���������Ӧ���ﵽƽ��ʱ���д�ʩ�����NOת���ʵ���________��
A��ѡ�ø���Ч�Ĵ��� B�����߷�Ӧ��ϵ���¶�
C�����ͷ�Ӧ��ϵ���¶� D����С���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һNa2SO3�����ֱ����������ʡ�Ϊ�ⶨ��Ʒ���ȣ��ס�����λͬѧ�ֱ����������ʵ�鷽����
����ͬѧ����ȡm g��Ʒ����ˮ�����������BaCl2��Һ�����ˣ�������м���������ᣬ�ٹ��ˣ�����������ϴ�Ӻ���к�ɣ���ȴ��Ƶ�����Ϊm1 g��
(1)BaCl2��Һ���������ԭ����___________________________________________������Һ�еμ�____________��Һ����û�а�ɫ�������ɣ���֤��BaCl2��Һ���㣬�����������Һ�м���BaCl2��Һ����й��ˡ�ϴ�Ӳ�������ķ�����__________________________________________________����ϴ��Һ�еμ�_______________��Һ�������жϲ��������Ƿ�ϴ�Ӹɾ���
(2)�жϲ�����������m1 g�ܹ���Ϊʵ��ⶨֵ�������ʽ��������Ʒ���ȣ����벹���ʵ�������_________________________________________________________��
����ͬѧ����ȡm g��Ʒ����ˮ�������Һ���õζ���ȡV mL����ƿ�У���Ũ��Ϊc mol/L�ı����Ը��������Һ�ζ����յ㡣��Ӧ��ϵΪ��SO32�� + MnO4�� SO42�� + Mn2+ (δ��ƽ)
(3)������Ʒ��Һʱ����һ����Ҫ��ʵ��������__________(ѡ��𰸱��)��
a������ƿ b�������� c���ζ��� d���ձ�
(4)�ζ��յ���ж�������___________________________________________________��
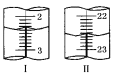
(5)�����ζ��У��ζ�����ע�����Ը��������Һ֮ǰ����������ˮϴ��������__________________________________________���ζ���Һ��仯��ͼ��ʾ����ͼ��ͼ����ʾ���ĵĸ��������Һ���Ϊ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)�����ؽṹ��ͼ���й�������ȷ����_____��ѡ����ţ���
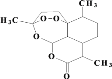
a����ѧʽΪC15H21O5 b��������NaOH��Һ��Ӧ
c��������ˮ d�����й��������н�ǿ������
��������Ϊԭ�ϳ��������岽�ϳɿɵõ������أ����е�2��Ϊ��ԭ��Ӧ��
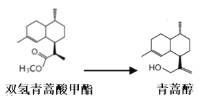
�����¼��ɷ�Ӧ���Է��ȣ���ԭ��ΪLiAlH4��������ʵ����ʣ�
���� | ���� |
˫�����������(C16H28O2) | ���壬������ˮ���������л��ܼ��� |
���ﴼ(C15H28O) | ���壬������ˮ���������л��ܼ��� |
���� | ��ɫҺ�壬����ˮ���ܶ�0.71g/cm3���е�34.6�档 |
�⻯��� | ���壬�������ѡ� ��ˮ��Ӧ��LiAlH4 + 4H2O ��Al(OH)3��+ LiOH +4H2�� �ɽ�һ��������ԭ�ɶ����Ӵ����������ɴ�������ﮡ� ����������﮿������ᷴӦ���������Ρ���κ���Ӧ�Ĵ����� |
ijѧϰС����ʵ������˫�������������ȡ���ﴼ��
(2)��Ӧ��ʹ�ù������⻯��ﮣ�������_____________________________________________��Ϊʹ��Ӧ����Һ״̬�½��У���������Ϊ�ܼ�������ˮ��������____________________��
(3)�����ʵ�����Ʊ�װ�ã�������ͼ����____________
(4)�÷�Ӧ�л����ת����ԼΪ96%������������Һ�к��д�ﮡ�������˫��������������⻯��ﮡ��ӷ�Ӧ���������ȡ���ﴼ�ķ����ǣ�
�ټ�_______���Һ��
�ڴ����Ѳ���ȡ���ﴼ���ж��ַ����������Ƕ��ַ�����
����һ�������ᾧ�� �������������������塣
a����2�����������������Ӧ�в���Һ��ԭ����___________________________________��
b�������2���������бȽ�_______________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����е�Ũ�ȵ�������Һ�������ᣬ�����ӣ��������ƣ���̼�ᣬ��̼���ƣ���̼�����ơ�����ҺpH��С����������ȷ����
![]()
![]() A. �ܢ٢ڢݢޢ� B. �ܢ٢ڢޢݢ�
A. �ܢ٢ڢݢޢ� B. �ܢ٢ڢޢݢ�
![]()
![]() C. �٢ܢڢޢۢ� D. �٢ܢڢۢޢ�
C. �٢ܢڢޢۢ� D. �٢ܢڢۢޢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���þ��Դ��Ϊ�ḻ�Ĺ���֮һ��
(1)��1molþ���Ͻ�(Mg17Al12)��ȫ�ܽ���12L 6mol/L�������У��ų�����______mol��Ϊʹ��Ӧ����Һ�е�Mg2+��Al3+��ȫ�����������10mol/L�İ�ˮ����______L��
(2)���ռ�ʽ̼��þ�ɵõ�MgO��ȡ��ʽ̼��þ4.66g�����������أ��õ�2g�����1.76g CO2��ijѧ��Ϊȷ����ʽ̼��þ�Ļ�ѧʽ���������������̣�
24+17x+60y+18z=4.66��(![]() )����
)����
2��x��2y=0����
(![]() )��(0.5x+z)��18=4.66��2��1.76����
)��(0.5x+z)��18=4.66��2��1.76����
(a)��ʽ������������ʽ̼��þĦ�������Ĺ�ϵʽ�����ʽ�������_______________��
(b)���Ϲ�ϵʽ����ȷ�ģ��ݴ˿�����ü�ʽ̼��þ�Ļ�ѧʽΪ________________________________��
(3)����þ��������������Ӧԭ��Ϊ��
MgO+H2O=Mg(OH)2 Mg(OH)2+SO2=MgSO3+H2O
MgSO3+H2O+SO2=Mg(HSO3)2 2MgSO3+O2=2MgSO4
ijС��ģ�������������(ʵ����25������)����MgO����ˮ�У����Ͻ��裬ͨ��SO2�Ϳ������õ�550g��Һ�����ɿ�������ȡ55g��Һ���μ��������������BaCl2��Һ���õ�0.897g��ɫ��������ȡ55g��Һ����������ˮ��BaCl2�����Һ���õ�1.992g��ɫ����������֪�����к�MgSO3 16.82g(�����ɷֲ�����Ԫ��)��
�ٸ�ʵ����������յ�SO2�����ʵ���Ϊ________mol���������������ʵ���Ϊ_______mol��
��Mg(HSO3)2������ˮ��25���ܽ�ȣ�MgSO4��33.7g/100gˮ��MgSO3��0.652g/100gˮ����ͨ������ȷ��550g��Һ��þ�εijɷּ����ʵ���(д���������)___________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com