
【题目】过氧化钠(Na2O2)是一种淡黄色固体,有两个实验小组的同学为探究其与二氧化碳的反应,都用下图所示的装置进行实验。一段时间后,将带余烬的木条插入试管D中,木条复燃。
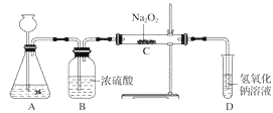
请回答下列问题:
(1)A是制取CO2的装置,写出A中发生反应的化学方程式:__________。
(2)第1小组同学认为Na2O2与CO2反应生成了Na2CO3和O2,该反应的化学方程式为________。
(3)第2小组同学认为除生成Na2CO3和O2外,还有可能生成NaHCO3,你认为呢?并简述原因_____。
(4)请设计一种实验方案证明Na2O2与CO2反应生成了Na2CO3: ______。
【答案】CaCO3+2HCl=CaCl2+H2O+CO2↑ 2Na2O2+2CO2=2Na2CO3+O2 不可能,根据质量守恒定律,反应物中没有氢元素,故不可能生成NaHCO3 取反应后生成的固体,加稀盐酸,生成使澄清石灰水变浑浊的气体(或取反应后生成的固体,加CaCl2溶液,生成白色沉淀或其他合理答案)
【解析】
装置A制备二氧化碳,装置B干燥二氧化碳,装置C中过氧化钠和二氧化碳反应生成碳酸钠和氧气,据此解答。
(1)实验室通常使用石灰石或大理石(主要成分都为碳酸钙)与稀盐酸反应制取二氧化碳,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,发生反应的化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)根据反应产生了能使带火星木条复燃的氧气,第一组同学认为,过氧化钠与二氧化碳反应生成碳酸钠和氧气;化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,书写方程式时,由于反应物中有气体二氧化碳,反应产物中的气体氧气不需再注明。
(3)碳酸氢钠由碳、氢、氧、钠四种元素组成,而反应物二氧化碳和过氧化钠中不含氢元素,根据质量守恒定律,反应生成碳酸氢钠的观点不正确;
(4)碳酸盐与稀盐酸反应可放出气体二氧化碳,因此,可取反应后的固体与稀盐酸反应,把产生的气体通入澄清石灰水,若石灰水变浑浊,可说明固体为碳酸盐;或者把反应后的固体溶于水,向所得溶液中滴加氯化钙,如产生白色沉淀,也可证明固体中含有碳酸根。


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案科目:高中化学 来源: 题型:
【题目】将3g两种金属混合物的粉末与足量的盐酸反应,反应完全后,得到标准状况下的氢气3.36 L。则这两种金属不可能是( )
A.Al和FeB.Ag和AlC.Mg和AlD.Zn和Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是利用燃料(如CO、H2、CH4等)与氧气反应,将反应产生的化学能转变为电能的装置,通常用氢氧化钾作为电解质溶液。完成下列关于甲烷(CH4)燃料电池的填空:
(1)甲烷与氧气反应的化学方程式为:
(2)已知燃料电池的总反应式为CH4+2O2+2KOH=K2CO3+3H2O,电池中有一极的电极反应为CH4+10OH--8e-= CO32-+7H2O,这个电极是燃料电池的 (填“正极”或“负极”),另一个电极上的电极反应式为:
(3)随着电池不断放电,电解质溶液的碱性 (填“增大”、“减小”或“不变”)
(4)通常情况下,甲烷燃料电池的能量利用率 (填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、NO、NO2、SO2等有毒气体会危害人体健康,破坏环境,对其进行无害处理研究一直是科技界关注的重点。请回答以下问题:
(1)汽车尾气中的CO、NO、NO2等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
已知:①2NO(g)+O2(g)=2NO2(g) ΔH1=-112.3kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) ΔH2=-234kJ·mol-1
③N2(g)+O2(g)=2NO(g) ΔH3=+179.5kJ·mol-1
请写出CO和NO2生成无污染气体的热化学方程式__。
(2)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH=-759.8kJ·mol-1,若反应达到平衡时,所得的混合气体中含N2的体积分数随
N2(g)+2CO2(g) ΔH=-759.8kJ·mol-1,若反应达到平衡时,所得的混合气体中含N2的体积分数随![]() 的变化曲线如图1。
的变化曲线如图1。

①a、b、c、d四点的平衡常数从大到小的顺序为__。
②若![]() =0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为__。
=0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为__。
(3)若将NO2与O2通入甲中设计成如图2所示装置,D电极上有红色物质析出,则A电极的电极反应式为__,经过一段时间后,若乙中需加0.1molCu2(OH)2CO3可使溶液复原,则转移的电子数为__NA。
(4)常温下,SO2可以用碱溶液吸收处理。若将SO2通入到NaOH溶液中,充分反应后得到amol·L-1的NaHSO3溶液,该溶液的pH=5,则该溶液中c(SO32-)___c(H2SO3)(填“>”、“=”或“<”),HSO3-的电离常数约为___(用含a的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推是在化学学习和研究中常用的思维方法,但类推出的结论最终要经过实践的检验才能决定其正确与否,下列几种类推结论中正确的是( )
A.由![]() 跟
跟![]() 直接化合可得
直接化合可得![]() ,类推出
,类推出![]() 跟
跟![]() 直接化合可得
直接化合可得![]()
B.金属镁失火不能用![]() 灭火,类推出金属钠失火也不能用
灭火,类推出金属钠失火也不能用![]() 灭火
灭火
C.![]() 与
与![]() 反应生成
反应生成![]() 和
和![]() ,类推出
,类推出![]() 与
与![]() 反应生成
反应生成![]() 和
和![]()
D.相同温度下![]() 的溶解度比
的溶解度比![]() 的溶解度小,类推出
的溶解度小,类推出![]() 的溶解度也小于
的溶解度也小于![]() 的溶解度
的溶解度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示是某品牌饮用矿泉水标签的部分内容。

请认真阅读标签内容,计算:
(1)镁离子的物质的量浓度的最大值_______。
(2)一瓶合格的这种矿泉水中硫酸根离子的物质的量不能超过多少_______?(单位:mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是“国际化学元素周期表年”。1869年门捷列夫把当时已知的元素根据物理、化学性质进行排列准确预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下。下列说法不正确的是( )
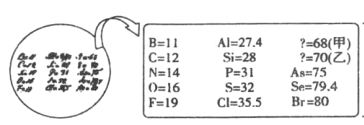
A.推测乙可以用作半导体材料
B.原子半径比较:甲>乙![]()
C.元素乙的简单气态氢化物的稳定性比![]() 弱
弱
D.元素甲的原子序数为21
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁和摩尔盐是铁的两种重要盐类,在净水和定量分析等方面具有重要作用。
(1) 用FeCl3溶液腐蚀印刷电路板上的铜,向所得溶液中加入铁粉,对加入铁粉充分反应后的溶液分析合理的是____________。
a. 若无固体剩余,则溶液中一定有Fe3+ b. 若有固体存在,则溶液中一定有Fe2+
c. 若溶液中有Cu2+,则一定没有固体析出 d. 若溶液中有Fe2+,则一定有Cu析出
(2)工业上通过氧化酸性FeCl2废液得到含FeCl3的溶液。若酸性FeCl2废液中 ![]() ,
,![]() ,
,![]() ,则该溶液的
,则该溶液的![]() 约为______(不考虑水的电离和离子的水解)。
约为______(不考虑水的电离和离子的水解)。
(3)摩尔盐 [(NH4)2Fe(SO4)26H2O]在定量分析中常作为基准物质,用来标定重铬酸钾、高锰酸钾等溶液的浓度,在![]() 的该盐的溶液中,离子浓度由大到小的顺序是____________。
的该盐的溶液中,离子浓度由大到小的顺序是____________。
(4)摩尔盐与酸性高锰酸钾发生反应:![]()
a.配平上述离子方程式:(___________)Fe2++(____________)MnO4-+(___________)H+→(_________)Mn2++(__________)Fe3++(___________)H2O
b.已知摩尔盐相对分子质量为![]() ,取摩尔盐产品
,取摩尔盐产品![]() (杂质不与高锰酸钾反应),配成
(杂质不与高锰酸钾反应),配成![]() 溶液,取出
溶液,取出![]() 用
用![]() 溶液滴定,消耗
溶液滴定,消耗![]() 溶液
溶液![]() ,则产品中摩尔盐的质量分数为____________(用小数表示,保留四位小数)。
,则产品中摩尔盐的质量分数为____________(用小数表示,保留四位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有物质的量浓度均为0.1mo/L的下列溶液:
(1)①NH3·H2O ②FeCl2 ③NaHSO4 ④KOH ⑤Ba(OH)2 ⑥H2SO4,其pH由大到小的顺序排列的是(填序号)___。
(2)写出氯化亚铁溶液中,亚铁离子水解的离子方程式___。
(3)写出硫酸氢钠与氢氧化钡2:1反应的离子方程式___。
(4)将氢氧化钾与氯化亚铁溶液混合,现象___。依次发生的化学方程式____、___。
(5)氯化亚铁保存时为何加少量铁粉___,若保存硫酸铁溶液时应向溶液中加入____。
(6)如何利用氯水和硫氰化钾检验氯化亚铁溶液中的Fe2+,写出加入试剂的先后顺序和对应现象__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com