
【题目】室温下,使用pH计测定0.1mol/LNH4Cl溶液的pH=5.12(如图)由此可以得到的结论是___(填字母)。

a.NH3·H2O是弱碱
b.溶液中c(H+)>c(OH-)
c.NH4+水解是吸热反应
d.由H2O电离出的c(H+)<10-7mol/L
e.物质的量浓度相等的氨水和盐酸等体积混合,溶液pH=7
(2)室温下,用0.10mol/LNaOH溶液分别滴定20.00mL0.10mol/L的盐酸和醋酸,滴定曲线如图所示
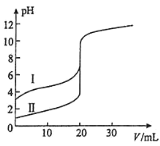
①表示滴定盐酸的曲线是_____(填序号)。
②若此实验选用酚酞为指示剂,则滴定到达终点的现象是_____。
③若用标准NaOH溶液测定未知盐酸溶液的浓度,下列实验操作会使实验结果偏低的是_____。
a.锥形瓶用待测液润洗后再注入待测液
b.碱式滴定管滴定前有气泡,滴定后无气泡
c.碱式滴定管滴定前仰视读数,滴定后平视读数
②在滴定醋酸溶液的过程中:V(NaOH)=10.00mL时,溶液中离子浓度由大到小的顺序为____________。当c(Na+)=c(CH3COO-)+c(CH3COOH)时,溶液pH________7(填“>”、“=”或“<”)。
【答案】ab Ⅱ 溶液由无色变为(浅)红色,且半分钟不变色 c c(CH3COO-)>c(Na+)>c(H+)>c(OH-) >
【解析】
(1)a.pH=5.12,正盐水溶液呈酸性,阳离子发生了水解,NH3·H2O是弱碱,a正确;
b.室温下溶液pH=5.12,溶液呈酸性,b正确;
c.实验中没有做有关热量变化的实验,无从得知NH4+水解是吸热反应,c不正确;
d.氯化铵促进了水的电离,所以由水电离出的c(H+)=10-5.12>10-7mol/L,d不正确;
e.物质的量浓度相等的氨水和盐酸等体积混合,生成的NH4Cl为强酸弱碱盐,水溶液显酸性,pH<7,e不正确;
答案为:ab;
(2)①盐酸为强酸,0.10mol/L的盐酸初始pH=1,由此确定对应的滴定曲线为Ⅱ;
起初锥形瓶中加酸,溶液呈无色,后来碱稍过量,溶液呈浅红色,滴定达终点时的现象为溶液由无色变为(浅)红色,且半分钟不变色;
a.锥形瓶用待测液润洗后再注入待测液,会使得酸的物质的量偏多,从而导致消耗NaOH的量增大,结果偏高,a不合题意;
b.碱式滴定管滴定前有气泡,滴定后无气泡,有一部分碱液填充了原来气泡的空间,耗碱量偏大,使得结果偏高,b不合题意;
c.滴定管刻度上小下大,滴定前仰视读数,使得读数偏大,滴定后平视读数,读数准确,差值偏小,结果偏小,c符合题意;
答案为:c;
②V(NaOH)=10.00mL时,在不考虑电离和水解的时候,溶质组成为1:1的CH3COONa和CH3COOH,图中可见pH<7,即c(H+)>c(OH-),醋酸电离程度大于醋酸根水解程度,所以c(CH3COO-)>c(Na+),又因为c(H+)和c(OH-)比c(CH3COO-)和c(Na+)小几个数量级,由此可得出离子浓度大小关系为c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。当c(Na+)=c(CH3COO—)+c(CH3COOH)时,NaOH加入20mL,恰好中和,此时溶质全是CH3COONa,强碱弱酸盐水溶液显碱性,所以pH>7。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),H=-akJmol-1,在5L密闭容器投入1molNH3和1mol的O2,2分钟后NO的物质的量增加了0.4mol,下列说法正确的是( )
4NO(g)+6H2O(g),H=-akJmol-1,在5L密闭容器投入1molNH3和1mol的O2,2分钟后NO的物质的量增加了0.4mol,下列说法正确的是( )
A.2分钟反应放出的热量值小于0.1akJ
B.用氧气表示0~2min的反应速率:v(O2)=0.05mol·L-1·min-1
C.2分钟内NH3的转化率是50%
D.2分钟末c(H2O)=0.6mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酮洛芬是一种良好的抗炎镇痛药,可以通过以下方法合成:
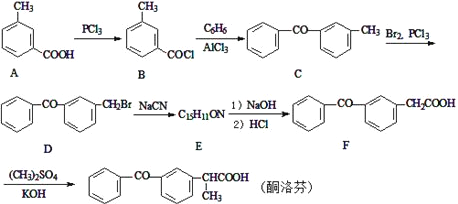
(1)化合物D中所含官能团的名称为___。
(2)化合物E的结构简式为________;由B→C的反应类型是____。
(3)写出C→D的反应方程式_____。
(4)写出同时满足下列条件的A的一种同分异构体的结构简式____。
I.能发生银镜反应;
Ⅱ.与FeCl3发生显色反应;
Ⅲ.分子中含有5种不同化学环境的氢
(5)请写出以甲苯为原料制备化合物![]() 的合成路线流程图(无机试剂和有机溶剂可任选,合成线路流程图示例见并难题题干)____。
的合成路线流程图(无机试剂和有机溶剂可任选,合成线路流程图示例见并难题题干)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为____________。
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中![]() 为:_____________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
为:_____________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(3)已知反应2HI(g) ===H2(g) + I2(g)的ΔH= +11kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为______________kJ。
(4)Bodensteins研究了下列反应:2HI(g)![]() H2(g) + I2(g)
H2(g) + I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为:___________。
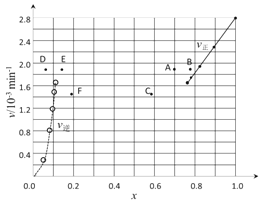
②上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为________(以K和k正表示)。若k正 = 0.0027min-1,在t=40min时,v正=________min-1
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2/span>)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为_________________(填字母)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.完成以下方程式:⑴写离子方程式,⑵⑶⑷写化学方程式
⑴Na与H2O:________________;
⑵氢氧化亚铁露置在空气中:________________;
⑶制粗Si:________________;
⑷少量CO2通入Na2SiO3溶液:________________。
II.有以下物质:①Fe2O3②Na2CO3③Cl2④浓盐酸⑤浓硫酸⑥SO2⑦高岭石Al2(Si2O5)(OH)4
⑸属于碱性氧化物的是________________(填序号);
⑹工业上用③与石灰乳制取漂白粉,漂白粉的有效成分的化学式是_____________;
⑺写出Cu与⑤反应的化学方程式________________。
⑻请将物质⑦改写成氧化物的形式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为常见的短周期主族元素,常温下,其最高价氧化物对应的水化物溶液(浓度均为 0.01mol/L)的pH和原子半径的关系如下图所示。其中,Y为碳元素。下列有关说法正确的是
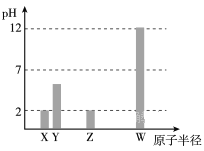
A. X是硫元素
B. Y的最高价氧化物的电子式为 ![]()
C. W的最高价氧化物对应的水化物中仅含离子键
D. Z的最高价氧化物对应水化物的化学式为HClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.1molN2中含有的分子数为2×6.02×1023B.电解饱和食盐水可得到金属钠
C.常温下,铝片能溶于浓硝酸D.常温下,淀粉溶液遇I2变成蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(HCHO)俗称蚁醛,是一种重要的有机原料。
I.利用甲醇(CH3OH)制备甲醛
脱氢法:CH3OH(g)=HCHO(g)+H2(g) △H1 = +92.09kJ/mol
氧化法:CH3OH(g) +1/2O2(g)=HCHO(g)+H2O(g) △H2
(1)已知:2H2(g)+O2(g)=2H2O(g) △H3=-483.64 kJ/mol,则△H2=_______。
(2)与脱氢法相比,氧化法在热力学上趋势较大,其原因为_______________。
(3)图1为甲醇制备甲醛反应的lg K(K为平衡常数)随温度(T)的变化曲线。曲线____(填“a”或“b”)对应脱氢法,判断依据为_________________。

II.甲醛的用途
(4)将甲醛水溶液与氨水混合蒸发可制得乌洛托品(结构简式如图2),该物质在医药等工业中有广泛用途。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为_______。
(5)将甲醛水溶液与硫酸镍(NiSO4)混合,可用于化学镀镍。若反应过程中有CO2产生,则该反应的离子方程式为____________________。
Ⅲ.甲醛的检测
(6)室内甲醛超标会危害人体健康,通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理如图3所示,则b极的电极反应式为_________,当电路中转移4×10-4 mol电子时,传感器内参加反应的HCHO为_______mg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国太阳能燃料生产示范工程在兰州落地,太阳能燃料的生产和利用示意如下:
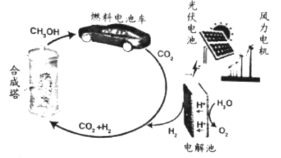
(1)图中能量转化形式中,产生电能的有:风能→机械能→电能、___________等(举一例)。
(2)在恒温恒容密闭容器中进行的合成反应为CO2(g)+ 3H2(g)![]() CH3OH(g)+ H2O(g)。
CH3OH(g)+ H2O(g)。
①该反应常用Cu/ZnO作催化剂。工业上由黄铜矿(CuFeS2)火法冶铜时,包含多步反应,其中Cu2S与Cu2O在高温下生成Cu并放出能使品红溶液褪色的气体,写出该步反应的化学方程式:_________。
②能说明反应已达到化学平衡状态的是_____(填标号)。
A.该容器中c(CH3OH): c(H2O)=1:1 B.生成CO2的速率与生成H2O的相等
C.混合气体的密度不再随时间变化 D.混合气体中CH3OH的体积分数不再随时间而变化
③若在容器中起始时充入1molCO2和3mol H2 ,测得t1 min时容器中n(H2)= n(H2O),此时容器中已生成CH3OH的物质的量为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com