
【题目】(1)海水中有丰富的食盐资源,工业上以粗食盐水(含少量Ca2+、Mg2+杂质)、氨、石灰石等为原料,可以制备Na2CO3。流程如下:

请回答:
①粗盐精制过程中加入的沉淀剂是石灰乳和纯碱,加入顺序是_____。
②上述流程中循环使用的物质是____。
③上图中制得的饱和食盐水还可用于氯碱工业,NaCl 溶液的电解产物可用于生产盐酸、漂白粉、氢氧化钠等产品。工业上电解饱和食盐水的离子方程式为_____。
④氨气可用电解法合成,其原料转化率大幅度提高, 有望代替传统的工业合成氨工艺。电解法合成氨的两种原理及装置如图 1 和图 2 所示。

图 1 中,a 电极上通入的X 为_____。图 2 中,d 电极上的电极反应式为_________。
(2)海水中有丰富的锂资源,我国科学家研发出利用太阳能从海水中提取金属锂的技术,提取原理如图 3 所示:

图 3
①金属锂在电极_____(填“A”或“B”)上生成。
②阳极产生两种气体单质,电极反应式是_____。
③某种锂离子二次电池的总反应为:FePO4(s)+Li(s)![]() LiFePO4(s) , 装置如下图所示(a 极材料为金属锂和石墨的复合材料)。下列说法不正确的是_____。
LiFePO4(s) , 装置如下图所示(a 极材料为金属锂和石墨的复合材料)。下列说法不正确的是_____。

A.图中 e-及 Li+移动方向说明该电池处于放电状态
B.该电池中a 极不能接触水溶液
C.充电时 a 极连接外接电源的正极
D.充电时,b 极电极反应式为:LiFePO4-e-= Li++ FePO![]()
【答案】先加入石灰乳,再加入纯碱 NH3、CO2 2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑ H2 N2+3H2O+6e-=2NH3+3O2- A 2Cl--2e-=Cl2↑、4OH--4e-=2H2O+O2↑ C
2OH-+H2↑+Cl2↑ H2 N2+3H2O+6e-=2NH3+3O2- A 2Cl--2e-=Cl2↑、4OH--4e-=2H2O+O2↑ C
【解析】
(1)由流程图可知,向粗盐水先加入石灰乳,再加入纯碱,镁离子和钙离子先后转化为氢氧化镁沉淀和碳酸钙,过滤得到精盐水,蒸发浓缩得到饱和食盐水;石灰石煅烧发生分解反应生成氧化钙和二氧化碳,向饱和食盐水中先通入氨气,再通如石灰石分解生成的二氧化碳,氯化钠、氨气和二氧化碳反应生成碳酸氢钠和氯化铵,过滤得到碳酸氢钠晶体和母液,碳酸氢钠固体受热发生分解反应生成碳酸钠、二氧化碳和水,反应生成的二氧化碳通入饱和食盐水中循环使用,向母液中加入石灰石分解生成的氧化钙,氧化钙与水反应生成氢氧化钙,氯化铵和氢氧化钙反应生成氯化钙、氨气和水,反应生成的氨气通入饱和食盐水中循环使用;
(2)由电子的移动方向可知,电子流入的一极电极A为电解池的阴极,海水中的锂离子经过锂离子交换膜进入有机电解液中,在阴极上得到电子发生还原反应生成锂,电子流出的一极B极为电解池的阳极,海水中的氯离子和氢氧根离子在阳极上失去电子发生氧化反应生成氯气和氧气。
(1)①加入石灰乳的目的是除去溶液中的镁离子,但过量的石灰乳会引入钙离子,所以应先加入石灰乳除去溶液中镁离子,再加入纯碱除去溶液中的钙离子,则沉淀剂加入的顺序为先加入石灰乳,再加入纯碱,故答案为:先加入石灰乳,再加入纯碱;
②由流程图可知,氯化钠、氨气和二氧化碳反应生成碳酸氢钠和氯化铵时,氨气和二氧化碳做反应物,而碳酸氢钠固体受热发生分解反应生成碳酸钠、二氧化碳和水以及氯化铵和氢氧化钙反应生成氯化钙、氨气和水时,氨气和二氧化碳做生成物,则氨气和二氧化碳可以循环使用,故答案为:NH3、CO2;
③工业上电解饱和食盐水制得氢氧化钠、氢气和氯气,电解的离子方程式为2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑,故答案为:2Cl-+2H2O
2OH-+H2↑+Cl2↑,故答案为:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
④由图1可知,与电源负极相连的b极为电解池的阴极, 通入的氮气在阴极上得到电子发生还原反应生成氨气,则与电源正极相连的a极是电解池的阳极,通入的氢气在阳极失去电子发生氧化反应生成氢离子;由图2可知,与电源正极相连的c极是电解池的阳极,氧离子在阳极上失去电子发生氧化反应生成氧气,与电源负极相连的d极为电解池的阴极,氮气在阴极上得到电子发生还原反应生成氨气,电极反应式为N2+3H2O+6e-=2NH3+3O2-,故答案为:H2;N2+3H2O+6e-=2NH3+3O2-;
(2)①由电子的移动方向可知,电子流入的一极电极A为电解池的阴极,海水中的锂离子经过锂离子交换膜进入有机电解液中,在阴极上得到电子发生还原反应生成锂,故答案为:A;
②海水中含有大量的氯离子,氯离子在阳极失去电子发生氧化反应生成氯气,电极反应式为2Cl--2e-=Cl2↑,海水中还存在氢氧根离子,氢氧根离子在阳极上失去电子发生氧化反应生成氧气,电极反应式为4OH--4e-=2H2O+O2↑,故答案为:2Cl--2e-=Cl2↑、4OH--4e-=2H2O+O2↑;
③A.由图中e-及Li+移动方向,则发生Li-e-=Li+,所以该电池处于原电池放电状态,故A正确;
B.a极为Li易与水发生反应,所以该电池中a极不能接触水溶液,故B正确;
C.放电时,负极反应式为Li-e-=Li+,则a为负极,充电时a极连接外接电源的负极,故C错误;
D.放电时,b极反应式为FePO4+Li++e-═LiFePO4,则充电过程中,b极电极反应式为:LiFePO4-e-═Li++FePO4,故D正确;
C不正确,故答案为:C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】氢化钠![]() 化合物中钠元素是
化合物中钠元素是![]() 价,NaH跟水反应放出
价,NaH跟水反应放出![]() ,下列叙述正确的是( )
,下列叙述正确的是( )
A.在NaH中的氢离子半径比锂离子半径大
B.在NaH中的氢离子的电子层排布与![]() 不相同
不相同
C.NaH跟水反应后溶液呈酸性
D.NaH中的氢离子被还原成氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示。若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )
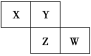
A. X的最常见气态氢化物的水溶液显酸性
B. 最高价氧化物对应水化物的酸性W比Z强
C. Z的单质与氢气反应比Y单质与氢气反应容易
D. X的原子半径小于Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同条件下分别测得反应 2SO2+O2![]() 2SO3 的化学反应速率,其中表示该反应进行得最快的是( )
2SO3 的化学反应速率,其中表示该反应进行得最快的是( )
A.v (SO3)=4mol/(L·min)B.v (O2)=6mol/(L·min)
C.v (SO2)=8mol/(L·min)D.v (O2)=3mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中进行反应![]() ,式中m、n、p、q为化学计量数。在
,式中m、n、p、q为化学计量数。在![]() min内,各物质物质的量的变化如下表所示:
min内,各物质物质的量的变化如下表所示:
物质 时间 | X | Y | Z | Q |
起始/mol | 0.7 | 1 | ||
2min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
3min末/mol | 0.8 |
已知2min内![]() ,
,![]() ,试确定以下物质的相关量:
,试确定以下物质的相关量:
(1)起始时![]() __________,
__________,![]() __________。
__________。
(2)方程式中m=__________,n=__________,p=__________,q=__________。
(3)用Z表示2min内的反应速率:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是用KMnO4与浓盐酸反应制取适量氯气的简易装置,以下说法正确的是

A.A中固体也可改用MnO2
B.B中需盛装饱和氯化钠溶液
C.氯气通入D中可以得到NaClO,该物质水溶液比HClO稳定
D.上图装置也可作为制取适量NO的简易装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向密闭恒容容器中加入1.0 mol·L-1X,发生反应:2X(g)![]() Y(g) + Z(g) ΔH<0。反应到8min时达 到平衡;在14min时改变温度,16min时建立新平衡。X的物质的量浓度变化如图所示。下列有关说法正确的是( )
Y(g) + Z(g) ΔH<0。反应到8min时达 到平衡;在14min时改变温度,16min时建立新平衡。X的物质的量浓度变化如图所示。下列有关说法正确的是( )
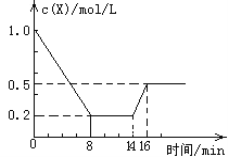
A. 0~8min用Y表示的该反应的速率为0.1mol·L-1·min-1
B. 8min时达到平衡,该反应的平衡常数为K=0.5
C. 14min时,改变的反应条件是降低了体系的温度
D. 16min时的正反应速率,比8min时的正反应速率大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中的pH判断或各微粒浓度关系,不正确的是( )
A.将![]() 的
的![]() 溶液与
溶液与![]() 溶液充分混合,若混合后溶液的体积为10mL,则混合液的
溶液充分混合,若混合后溶液的体积为10mL,则混合液的![]()
B.将![]() 的某一元酸HA溶液和
的某一元酸HA溶液和![]() 溶液等体积混合,混合液pH大于7,则反应后的混合液中:
溶液等体积混合,混合液pH大于7,则反应后的混合液中:![]()
C.pH相等的![]()
![]()
![]() 溶液中,
溶液中,![]() 大小关系:
大小关系:![]()
D.常温下,![]() 的
的![]() 和NaClO的混合溶液中:
和NaClO的混合溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是![]()
A.反应![]() 室温下不能自发进行,则该反应的
室温下不能自发进行,则该反应的![]()
B.铅蓄电池放电过程中,正极质量增加,负极质量减小
C.![]() 下,在
下,在![]() 稀溶液中,加水,
稀溶液中,加水,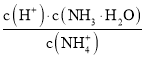 的值不变
的值不变
D.在NaHS溶液中,滴入少量![]() 溶液产生黑色沉淀,
溶液产生黑色沉淀,![]() 水解程度增大,pH增大
水解程度增大,pH增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com