
【题目】我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他利用NaHCO3、NaCl、NH4Cl等物质溶解度的差异,以食盐、氨气、二氧化碳等为原料先制得NaHCO3,进而生产出纯碱。下面是在实验室中模拟“侯氏制碱法”制取NaHCO3的实验步骤:
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让一装置发生反应,直到产生的气体不能再在C中溶解时,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:过滤C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的NaCl粉末,有NH4Cl晶体析出。……
请回答下列问题(提示B分液漏斗中为浓氨水,滴入烧瓶可产生氨气):
(1)装置的连接顺序是:(a)接________,________接________;(b)接________


(2)A中常选用的固体反应物为______________;D中应选用的液体为________________(填化学式)。
(3)第二步骤中必须先让__________装置先发生反应。
(4)C中用球形干燥管而不用直导管,其作用是______________________________,C中广口瓶内产生固体的总化学方程式为______________________ 。
(5)在第四步中分离NH4Cl晶体的操作是____________________(填操作名称);其所得的NH4Cl晶体中常含有少量的NaCl和NaHCO3(约占5%~8%),请设计一个简单的实验证明所得固体的成分中含有Na+,简要写出操作和现象____________________________________。
【答案】f e d c CaCO3 NaHCO3 B 防倒吸 H2O+CO2+NH3+NaCl===NaHCO3↓+NH4Cl 过滤 用一根洁净的铂金丝蘸取少量固体进行焰色反应,若火焰呈黄色,则含有Na+
【解析】
(1)根据装置A制取CO2,装置B制取NH3,装置D除去二氧化碳中的HCl,二氧化碳与氨气通入C中应防止倒吸,据此分析连接仪器装置;
(2)根据A装置是制备二氧化碳气体,二氧化碳气体中含有氯化氢气体分析解答;
(3)氨气易溶于水,二氧化碳在水中的溶解度较小,据此判断;
(4)根据氨气极易溶于水判断C中用球形干燥管的原因;C中广口瓶内产生固体NaHCO3,依据侯氏制碱法原理书写方程式;
(5)分离氯化铵沉淀通常用过滤操作,检验钠离子一般用焰色反应分析解答。
(1)根据题干信息可知装置A产生CO2,装置B产生NH3,由于生成的二氧化碳中含有氯化氢会干扰实验,所以装置D除去二氧化碳中的HCl,氨气极易溶于水,氨气通入C中应防止倒吸,则b接c,a接f、e接d;
(2)A装置是制备二氧化碳气体的反应,所以固体为CaCO3,生成的二氧化碳气体中含有氯化氢,若不除去碳酸氢钠难以形成,所以应该用饱和碳酸氢钠溶液除去;
(3)候氏制碱方法是利用氨气溶解性大极易溶解于水,二氧化碳气体水中溶解性较小,实验时饱和食盐水中先通入氨气,再通入二氧化碳气体,因此实验操作过程中,应让B装置先发生反应;
(4)氨气极易溶于水,用直导管向饱和氯化钠溶液中通入氨气,容易发生倒吸,C中用球形干燥管球形部分液面上升慢起缓冲作用,可以防止倒吸;侯氏制碱法,也称为联合制碱法,化学反应原理是用氨气和二氧化碳与氯化钠饱和溶液反应生成碳酸氢钠,然后加热碳酸氢钠制取碳酸钠,所以C中广口瓶内产生固体的总化学方程式为H2O+CO2+NH3+NaCl=NaHCO3↓+NH4Cl;
(5)第四步:向滤液中加入适量的NaCl粉末,有NH4Cl晶体析出,分离固体和液体用过滤的方法。证明所得固体的成分中含有Na+的实验操作和现象为:用一根洁净的铂金丝蘸取少量固体进行焰色反应,若火焰呈黄色,则含有Na+。


科目:高中化学 来源: 题型:
【题目】聚合物H (![]() )是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:
)是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:

已知:①C、D、G均为芳香族化合物,分子中均只含两种不同化学环境的氢原子。
②Diels﹣Alder反应:![]() 。
。
(1)生成A的反应类型是________。D的名称是______。F中所含官能团的名称是______。
(2)B的结构简式是______;“B→C”的反应中,除C外,另外一种产物是______。
(3)D+G→H的化学方程式是___________________________________________。
(4)Q是D的同系物,相对分子质量比D大14,则Q可能的结构有_____种,其中核磁共振氢谱有4组峰,且峰面积比为1:2:2:3的结构简式为__________________________________(任写一种)。
(5)已知:乙炔与1,3﹣丁二烯也能发生Diels﹣Alder反应。请以1,3﹣丁二烯和乙炔为原料,选用必要的无机试剂合成  ,写出合成路线_______________________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
,写出合成路线_______________________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为672 mL的烧瓶中充满NO和NO2的混合气体,将其倒立在水槽里,去塞后再通入280 mL氧气,恰好完全反应,且液体充满烧瓶(气体体积都已折合为标准状况下的体积),下列有关叙述正确的是( )
A. 总反应为NO+NO2+O2+H2O===2HNO3
B. 总反应为4NO+8NO2+5O2+6H2O===12HNO3
C. 生成硝酸的物质的量浓度均为0.030 mol·L-1
D. 生成硝酸的物质的量浓度约为0.060 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种杀菌消毒效率高、二次污染小的水处理剂,实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O据此,下列说法不正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O据此,下列说法不正确的是( )
A. KClO3发生还原反应
B. H2C2O4在反应中被氧化
C. H2C2O4的氧化性强于C1O2的氧化性
D. 每1mol C1O2生成,该反应转移的电子数约为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸H2C2O4为二元弱酸,Kal(H2C2O4)=5.4×10-2,Ka2(H2C2O4)=5.4×10-5)。室温下向0.lmol·L-l的Na2C2O4溶液中缓慢通入HCl气体直至过量(忽略溶液体积变化和HCl的挥发)。该过程中得到的下列溶液中微粒的物质的量浓度关系一定正确的是( )
A.0.lmol·L-lNa2C2O4溶液:c(Na+)>c(C2O![]() )>c(HC2O
)>c(HC2O![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B.pH=7的溶液:c(Na+)=2c(C2O![]() )+c(HC2O
)+c(HC2O![]() )
)
C.c(C2O![]() )=c(HC2O
)=c(HC2O![]() )的溶液:c(Cl-)>c(C2O
)的溶液:c(Cl-)>c(C2O![]() )+2c(H2C2O4)
)+2c(H2C2O4)
D.c(Na)=2c(Cl-)的溶液:c(Na+)+c(H+)>c(Cl-)+c(HC2O![]() )+c(C2O
)+c(C2O![]() )+c(H2C2O4)+c(OH-)
)+c(H2C2O4)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中的原因或结论与现象不对应的是
选项 | 现象 | 原因或结论 |
A | 在H2O2中加入MnO2,能加速H2O2的分解速率 | MnO2降低了反应所需的活化能 |
B | 将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深 | 2NO2(g) |
C | 在密闭容器中有反应:A+xB(g) | A为非气体、x=1 |
D | 向5mL 0.005mol·L-1FeCl3溶液中加入5mL 0.015mol·L-1 KSCN溶液,溶液呈红色,再滴加几滴1mol·L-1 KSCN溶液,溶液颜色加深 | 增大反应物浓度,平衡向正反应方向移动 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表格中的各种情况,可以用对应选项中的图像表示的是
选项 | 反应 | 甲 | 乙 |
A | 外形、大小相近的金属和水反应 | Na | K |
B | 4mL0.01mol·L-1 KMnO4溶液分别和不同浓度的2mLH2C2O4(草酸)溶液反应 | 0.1mol·L-1的H2C2O4溶液 | 0.2mol·L-1的H2C2O4溶液 |
C | 5mL0.1mol·L-1Na2S2O3溶液和5mL0.1mol·L-1H2SO4溶液反应 | 热水 | 冷水 |
D | 5mL4%的过氧化氢溶液分解放出O2 | 无MnO2粉末 | 加MnO2粉末 |
A.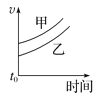 B.
B.
C. D.
D.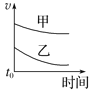
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. ![]() 、
、![]() 为不同的核素,化学性质也不同
为不同的核素,化学性质也不同
B. 乙醇和乙醚互为同分异构体
C. CH3CH(CH3)2的名称叫2-甲基丙烷,也可以叫做异丁烷
D. CH2=CH2和CH2=CH-CH=CH2具有相同的官能团,互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氯气生产某些含氯有机物时会产生副产物氯化氢。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
已知:①反应A中,4 mol氯化氢被氧化,放出115.6 kJ的热量。
②
(1)断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为________kJ,
(2)水分子中H—O键比氯化氢分子中H—Cl键(填“强”或“弱”)________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com