
【题目】关于下列几种离子晶体,说法不正确的是( )
A.由于![]() 晶体和
晶体和![]() 晶体中正、负离子半径比
晶体中正、负离子半径比![]() 不相等,所以两晶体中离子的配位数不相等
不相等,所以两晶体中离子的配位数不相等
B.![]() 晶体中,
晶体中,![]() 配位数为8,
配位数为8, ![]() 配位数为4,不相等,主要是由于
配位数为4,不相等,主要是由于![]() 、
、![]() 电荷数(绝对值)不相同
电荷数(绝对值)不相同
C.![]() 的熔点比的
的熔点比的![]() 高主要是因为
高主要是因为![]() 的晶格能比
的晶格能比![]() 大
大
D.![]() 晶体固态时也能导电
晶体固态时也能导电
科目:高中化学 来源: 题型:
【题目】为了探究乙醇和金属钠反应生成![]() 的原理,某同学做了如下四个实验。
的原理,某同学做了如下四个实验。
甲:向小烧杯中加入无水乙醇,再放入一小块金属钠,观察现象,并收集产生的气体
乙:设法检验甲收集到的气体。
丙:向试管中加人![]() 水,并加入绿豆粒大小的金属钠,观察现象。
水,并加入绿豆粒大小的金属钠,观察现象。
丁:向试管中加人![]() 乙醚(
乙醚(![]() ),并加入绿豆粒大小的金属钠,发现无明显变化。
),并加入绿豆粒大小的金属钠,发现无明显变化。
回答以下问题:
(1)从结构上分析,该实验选取水和乙醚作参照物的原因是__________。
(2)丙的目的是证明_____________;丁的目的是证明_______;根据丙和丁的结果,可以得出乙醇和金属钠反应的化学方程式应为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式或离子方程式正确的是
A.已知H2的标准燃烧热ΔH=-285.8 kJ·mol-1,则用热化学方程式可表示为:H2(g)+1/2O2(g)===H2O(g)ΔH=-285.8 kJ·mol-1
B.NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O===Fe(OH)2↓+2HClO
C.NH4HSO3溶液与足量NaOH溶液共热:NH4++H++2OH-![]() NH3↑+2H2O
NH3↑+2H2O
D.用足量KMnO4溶液吸收SO2气体:2MnO4-+5SO2+2H2O===2Mn2++5SO42-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是

A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的c(SO42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阴阳离子离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在20世纪90年代末期,科学家发现并证明碳有新的单质形态![]() 存在。后来人们又相继得到了
存在。后来人们又相继得到了![]() 、
、![]() 、
、![]() 、
、![]() 等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家族。下列有关说法错误的是
等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家族。下列有关说法错误的是

A. 熔点比较: ![]()
B. ![]() 、
、![]() 、管状碳和洋葱状碳之间的转化属于化学变化
、管状碳和洋葱状碳之间的转化属于化学变化
C. ![]() 晶体结构如上图所示,每个
晶体结构如上图所示,每个![]() 分子周围与它最近且等距离的
分子周围与它最近且等距离的![]() 分子有12个
分子有12个
D. ![]() 、
、![]() 、管状碳和洋葱状碳都不能与
、管状碳和洋葱状碳都不能与![]() 发生反应
发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值.下列说法正确的是( )
A. 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
B. 室温下,1 L pH=13的NaOH溶液中,由水电离的OH﹣离子数目为0.1NA
C. 氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA
D. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 晶体的晶胞结构与
晶体的晶胞结构与![]() 晶体的相似(如下图所示),但
晶体的相似(如下图所示),但![]() 晶体中由于哑铃形
晶体中由于哑铃形![]() 的存在,使晶胞沿一个方向拉长。则关于
的存在,使晶胞沿一个方向拉长。则关于![]() 晶体的描述不正确的是( )
晶体的描述不正确的是( )
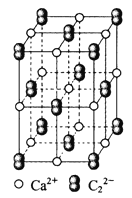
A.![]() 晶体的熔点较高,硬度也较大
晶体的熔点较高,硬度也较大
B.与![]() 距离相同且最近的
距离相同且最近的![]() 构成的多面体是正六面体
构成的多面体是正六面体
C.与![]() 距离相同且最近的
距离相同且最近的![]() 有4个
有4个
D.上图的结构中共含有4个![]() 和4个
和4个![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)基态O原子核外电子排布式为_______,基态P原子核外占据最高能级的电子云轮廓图为_________形;
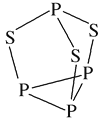
(2)P4S3可用于制造火柴,其分子结构如图所示。P4S3分子中硫原子的杂化轨道类型为___________,每个P4S3分子中含孤电子对的数目为_______。
(3)Na、O、S简单离子半径由大到小的顺序为__________
(4)SO2易溶于水,在水中的溶解度为1体积的水溶解40体积的SO2,原因是________。
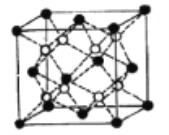
(5)Li2O的晶胞如图所示(其中白球代表Li,黑球代表O)。已知晶胞参数为0.4665 nm,阿伏加德罗常数的值为NA,则Li2O的密度为______g·cm3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知ClCH=CHCl 有两种结构:![]() 和
和![]() ,像这种由于双键不能自由旋转形成的异构体,叫顺反异构体,下列烯烃存在顺反异构现象的是
,像这种由于双键不能自由旋转形成的异构体,叫顺反异构体,下列烯烃存在顺反异构现象的是
A.CH2=CH2B.CH3CH=CH2
C.CH3CH=CHCH3D.CH3CH=C(CH3)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com