
一定量CO2通入某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(CO2)的关系如图所示。下列有关叙述正确的是 ( )

A.通入的CO2气体在标准状况下可能大于22.4 L
B.A溶液中n(NaOH)=2n(Na2CO3)
C.A溶液中既含Na2CO3,又含NaHCO3
D.A溶液中一定只有Na2CO3
 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| x |
| y |
| x |
| y |
查看答案和解析>>
科目:高中化学 来源: 题型:
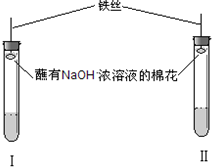
| 实验操作 | 实验现象 | 探究结论 |
| A.取少量品红溶液加入试管Ⅰ中,加入适量碳酸钠溶液,充分混合后再加入一定量的稀硫酸,并立即塞上塞子 | 溶液的红色逐渐褪去,加稀硫酸后溶液逐渐变红色 | CO2 |
| B.取少量品红溶液加入试管Ⅱ中,加入适量亚硫酸钠溶液,充分混合后再加入一定量的稀硫酸,并立即塞上塞子 | 溶液的红色逐渐褪去,加稀硫酸后溶液逐渐变红,随着反应的进行,颜色又逐渐消失 | SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省潍坊高密市高三4月月考理综化学试卷(解析版) 题型:实验题
Ⅰ.某实验小组把CO2通入饱和Na2CO3溶液制取NaHCO3,装置如图所示(气密性已检验,部分夹持装置略):

(1)请结合化学平衡移动原理解释B中溶液的作用?? ??????????????????????? ??? 。
(2)当D中有大量白色固体析出时,停止实验,将固体过滤、洗涤,取一定量配成样液,并加入BaCl2溶液,出现白色沉淀并有气体产生,其离子方程式是?? ??????????????????????????????? ?? 。
Ⅱ.某课外活动小组欲利用氨气与CuO反应,研究氨气的性质并测其组成,设计了如下实验(夹持装置未画出)进行实验。请回答下列问题:

(1)仪器b中可选择的试剂为(任意填一种)???????????? 。
(2)实验中,装置C中黑色CuO粉末全部转化为红色固体(已知Cu2O也为红色固体),量气管中有无色无味的气体。实验前称取黑色CuO 80g,实验后得到红色固体质量为68g。则红色固体成分的化学式为?????????????? 。
(3)F中读取气体体积前,应向上或向下移动右管,使得左右两边液面相平,若无此操作,而F中左边液面低于右边液面,会导致读取的气体体积??????? (填“偏大”或“偏小”或“无影响”)。
(4)要想测得氨气分子中氮、氢原子个数比,实验中应至少测量或读取哪些数据??????? (填序号)。
a.B装置实验前后质量差mg;???? b.F装置实验前后液面差VL
c.D装置实验前后质量差mg;???? d.E装置实验前后质量差mg;
(5)E装置中浓硫酸的作用是????????????????????????????????????????????????? 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com