
【题目】2018年,一档《辉煌中国》电视纪录片,让“厉害了,我的国”成了不少人的口头禅。我国科技创新成果卓越,下列成果中获得诺贝尔奖的是( )
A.侯德榜发明联合制碱法B.屠呦呦发现抗疟新药青蒿素
C.闵恩泽研发石油炼制催化剂D.张青莲主持测定了几种元素相对原子质量的新值
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为1.0L的恒容密闭容器中发生反应:2CH3OH(g)CH3OCH3(g)+H2O(g)
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O | ||
Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
下列说法正确的是( )
A.该反应的正反应为放热反应
B.达到平衡时,容器Ⅰ中的CH3OH体积分数比容器Ⅱ中的小
C.容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的长
D.若起始时向容器Ⅰ中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增加的前四周期的主族元素A~I,有关性质如下:
元素代号 | A | B | C | D | E | F | G | H | I |
原子半径/nm | 0.037 | 0.074 | 0.073 | 0.071 | 0.143 | 0.102 | 0.099 | 0.197 | 0.114 |
主要化合价 | +1 | +5、-3 | -2 | -1 | +4、-4 | +6、-2 | +7、-1 | +2 | +7、-1 |
已知E的单质是一种常见的半导体材料,分析表中数据,回答有关问题:
(1)元素G在周期表中的位置是_______,元素C的气态氢化物的电子式为_______。
(2)元素A、B、G可形成化合物B A4G,该化合物中存在的化学键有_______, E的单质晶体属于_______晶体(填“离子”、“分子”或“原子”),
(3)元素D、G、I的非金属性由强到弱的顺序是________(用元素符号表示),
(4)元素C、D的气态氢化物的稳定性顺序为_______(用化学式表示),元素D的单质可以将元素C从化合物A2C中置换出来,该置换反应的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据Ca(OH)2/CaO 体系的能量循环图:
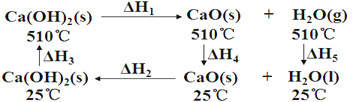
下列说法正确的是( )
A. △H5>0
B. △H1+△H2=0
C. △H3=△H4+△H2
D. △H1+△H2+△H3+△H4+△H5=0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气频繁出现,严重影响人们的生活和健康。其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断试样的pH=_________。
(2)汽车尾气中NOx和CO的生成:
①已知汽缸中生成NO的反应为:N2(g)+O2(g)![]() 2NO(g) △H>0恒温,恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是____
2NO(g) △H>0恒温,恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是____
A.混合气体的密度不再变化 B.混合气体的平均分子量不再变化
C.N2、O2、NO的物质的量之比为1∶1∶2 D.氧气的百分含量不再变化
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)=2C(s)+O2(g),已知该反应的△H>0,则该设想能否实现______________(填“能”或“不能”)
(3)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:
H2(g)+ 1/2O2(g) =H2O(g) △H=-241.8kJ·mol-1
C(s)+1/2O2(g) =CO(g)△H =-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式:___________________。
②洗涤含SO2的烟气。
(4)汽车尾气净化的主要原理:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g);△H<0,若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是_________(填序号)。(如图中v正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
2CO2(g)+N2(g);△H<0,若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是_________(填序号)。(如图中v正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)

车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”之一。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质)。一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
物质 温度/℃ | 活性炭 | NO | E | F |
初始 | 3.000 | 0.10 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
(1)写出NO与活性炭反应的化学方程式______________________;
(2)计算上述反应T1℃时的平衡常数K1=__________________;若T1<T2,则该反应的△H__________________0(填“>”、“<”或“=”)。
(3)上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为________;
【答案】 4 D 不能 C(s)+H2O(g)=CO(g)+H2(g) △H= +131.3 kJmol-1 BD C(s)+2NO(g)=CO2(g)+N2(g) 4 < 80%
【解析】(1)根据表格提供的离子可知,NH4+ 水解导致试样溶液呈酸性,再根据电荷守恒可知,c(K+)+c(NH4+ )+c(Na+)+c(H+)=2c(SO42-)+c(Cl-)+c(NO3-),将表格中的数据代入得H+离子浓度为10-4,则PH值为4。
(2)①在恒容密闭容器中,混合气体的质量和体积始终不变,混合气体的密度也始终不变,密度不能作为达到平衡状态的判据,A项错误;该反应是气体体积不变的可逆反应,根据M=质量/n,则混合气体的平均分子量始终不变,不能作为达到平衡的判据,B项错误;N2、O2、NO的物质的量之比为1∶1∶2不能说明反应各物质的浓度保持不变,C项错误;氧气的百分含量不再变化,说明反应达到平衡状态,D项正确;答案选D。
②化学反应2CO(g)=2C(s)+O2(g)是一个熵减、吸热的反应,则△H-T△S>0,所以该设想不能实现。
(3)已知:①H2(g)+ 1/2O2(g) =H2O(g) △H=-241.8kJ·mol-1、②C(s)+1/2O2(g) =CO(g) △H =-110.5kJ·mol-1,利用盖斯定律,将②-①可得C(s)+H2O(g)=CO(g)+H2(g)△H=(-110.51kJmol-1)-(-241.81kJmol-1)=+13l.3 kJmol-1,所以焦炭与水蒸气反应的热化学方程式为C(s)+H2O(g)=CO(g)+H2(g) △H= +131.3 kJmol-1 。
(4)可逆反应达化学平衡状态时正逆反应速率不再变化,A项错误;该物质的浓度在化学平衡时保持不变,所以K不再变化,B项正确;对于恒容容器而言,各物质的物质的量不再改变,C项错误;平衡时NO的质量分数不再改变,D项正确,答案选BD。
(5)①由表中数据可知,C、NO、E、F的化学计量数之比为0.040:0.080:0.040:0.040 =1:2:1:1,反应中C被氧化,结合原子守恒可知,生成物为N2与CO2,且该反应为可逆反应,则反应方程式为C(s)+2NO(g) CO2(g)+N2(g)。
②从表中数据可知T1℃时的平衡浓度c(NO)=0.004mol/L,c(N2)=c(CO2)=0.008 mol/L,则T1℃时该反应的平衡常数为K1=(0.008×0.008)÷(0.004×0.004)=4从T1到T2,NO的浓度增大,说明平衡逆向移动,若T1<T2,升高温度,平衡向吸热反应方向移动,则该反应的正向为放热反应,则△H < 0。
③在T1时,K=4,设NO的转化率为x,根据三段式解答:
C(s)+2NO(g) CO2(g)+N2(g)
起始浓度 0.04 0 0
变化浓度 0.04x 0.02x 0.02x
平衡浓度 0.04-0.04x 0.02x 0.02x
K=[0.02x×0.02x]÷[(0.04-0.04x)×(0.04-0.04x)=4,解得x=0.8,即达到新的平衡时,NO的转化率为80%。
【题型】填空题
【结束】
10
【题目】钛被称为“二十一世纪金属”,工业上用钛铁矿制备金属钛的工艺流程如下:

已知:钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,TiOSO4遇水会水解。请回答下列问题:
(1)操作1用到的玻璃仪器除烧杯外还有_________;
(2)请结合化学用语解释将TiO2+转化为H2TiO3的原理_______________。
(3)已知钛的还原性介于铝与锌之间。如果可从Na、Zn、Fe三种金属中选一种金属代替流程中的镁,那么该金属跟四氯化钛反应的化学方程式是____________。
(4)电解TiO2来获得Ti是以TiO2作阴极,石墨为阳极,熔融CaO为电解质,用碳块作电解槽,其阴极反应的电极反应式是___________________________________。
(5)为测定溶液中TiOSO4的含量,先取待测钛液10 mL用水稀释至100 mL,加过量铝粉,充分振荡,使其完全反应:3TiO2+ +Al+6H+=3Ti3++Al3++3H2O。过滤后,取无色滤液20.00 mL,向其中滴加2~3滴KSCN溶液作指示剂,用______________________(填一种玻璃仪器的名称)滴加0.1000mol·L-1 FeCl3溶液,发生Ti3++Fe3+=Ti4++Fe2+。滴定终点时的现象是___________________________________,若用去了30.00mL FeC13溶液,待测钛液中TiOSO4的物质的量浓度是______________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液氨和二硫化碳在一定条件下反应可以生成甲和乙两种盐。2.55g乙受热完全分解生成等物质的量的气体丙和丁共2.24L(标况),丙能使紫色石蕊试液变蓝,另取少量FeCl3溶液,向其中滴加甲溶液,发现溶液变为血红色。请推测并回答:
(1)写出乙的阴离子的电子式______。
(2)往上述血红色溶液中通入SO2,发现溶液红色褪去,请解释红色褪去的原因(用离子方程式表示)______。
(3)甲溶液中加入足量浓NaOH溶液,加热后也能生成气体丙,写出液氨和二硫化碳反应发生成甲和乙的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2 , 所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p﹣CP,探究有关因素对该降解反应速率的影响. [实验设计]控制p﹣CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验:
(1)请完成以下实验设计表:(表中不要留空格)
实验编号 | 实验目的 | T/K | pH | c/10﹣3 molL﹣1 | |
H2O2 | Fe2+ | ||||
① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
② | 探究温度对降解反应速率的影响 | 3 | |||
③ | 298 | 10 | 6.0 | 0.30 | |
(2)[数据处理]实验测得p﹣CP的浓度随时间变化的关系如图: 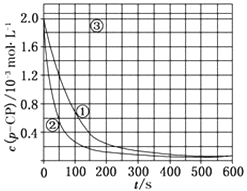
请根据上图实验①曲线,计算降解反应50~150s内的反应速率:v(p﹣CP)=molL﹣1s﹣1;
(3)[解释与结论] 实验①、②表明温度升高,降解反应速率增大.但后续研究表明:温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:;
(4)实验③得出的结论是:pH等于10时,反应(填“能”或“不能”)进行;
(5)[思考与交流] 实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】始组鸟(pterodactyl adiene)形状如一只展翅飞翔的鸟,其键线式结构表示如图,其中R1、R2为烷烃基.则下列有关始祖鸟烯的说法中正确的是
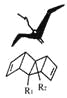
A. 始祖鸟烯与乙烯互为同系物
B. 若R1=R2=甲基,则其化学式C12H16
C. 若R1=R2=甲基,则始祖鸟烯的一氯代物有3种
D. 始祖鸟烯既能使酸性高锰酸钾褪色,也能使溴水褪色,则两反应的反应类型是相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修5:有机化学基础】功能高分子I的一种合成路线如下,其中D能与Na反应生成H2,且D苯环上的一氯代物有2种。

已知:![]()
回答下列问题:
(1)A的名称为________,试剂a为________。
(2)C的结构简式为________。
(3)F中的官能团名称为________。
(4)上述①~⑧的反应中,不属于取代反应的是________(填数字编号)。写出反应⑦的化学方程式________。
(5)符合下列条件的B的同分异构体有________种(不考虑立体异构)。
①苯环上有氨基(—NH2) ②能发生银镜反应
其中核磁共振氢谱有4组峰,且峰面积比为2∶2∶2∶1的结构简式为________。
(6)参照上述合成路线,以1-丁烯为原料(无机试剂任选),设计制备乳酸(![]() )的合成路线________。
)的合成路线________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com