
【题目】饮用水中含有砷会导致砷中毒,水体中溶解的砷主要以As(Ⅲ)亚砷酸盐和As(Ⅴ)砷酸盐形式存在.
(1)砷与磷为同一主族元素,磷的原子结构示意图为 .
(2)根据元素周期律,下列说法正确的是 . a.酸性:H2SO4>H3PO4>H3AsO4
b.原子半径:S>P>As
c.非金属性:S>P>As
(3)关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3 , 同时生成SO42﹣ , 导致砷脱离矿体进入地下水.FeS2被O2氧化的离子方程式为 .
(4)去除水体中的砷,可先将As(Ⅲ)转化为As(Ⅴ),选用NaClO可实现该转化.研究NaClO投加量对As(Ⅲ)氧化率的影响得到如下结果: 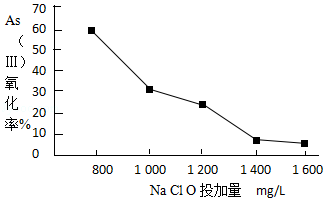
已知:投料前水样pH=5.81,0.1mol/LNaClO溶液pH=10.5,溶液中起氧化作用的物质是次氯酸.产生此结果的原因是 .
(5)强阴离子交换柱可以吸附以阴离子形态存在的As(Ⅴ)达到去除As的目的. 已知:一定条件下,As(Ⅴ)的存在形式如表所示:
pH | <2 | 2~7 | 7~11 | 11~14 |
存在形式 | H3AsO4 | H2AsO3﹣ | HAsO42﹣ | HAsO42﹣、AsO43﹣ |
pH=6时,NaClO氧化亚砷酸(H3AsO3)的离子方程式是 .
【答案】
(1)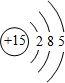
(2)ac
(3)4FeS2+15O2+14H2O=4Fe(OH)3+8SO42﹣+16H+
(4)起氧化作用的物质是次氯酸,NaClO溶液为碱性,当加入量大时,溶液碱性增强,NaClO溶液浓度增大,水解程度降低,次氯酸不易生成,所以As(Ⅲ)氧化率降低
(5)HClO+H3AsO3 =H2AsO4﹣+Cl﹣+2H+
【解析】解:(1)磷原子核外电子数为15,有3个电子层,由里到外各层电子数为2、8、5,磷原子结构示意图为 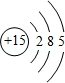 ,故答案为:
,故答案为: 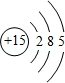 ;(2)a.同周期自左而右非金属性增强,最高价氧化物对应水化物酸性增强,同主族自上而下非金属性减弱,最高价氧化物对应水化物酸性减弱,酸性:H2SO4>H3PO4>H3AsO4 , 故a正确;b.同周期自左而右原子半径减小,同主族自上而下原子半径依次增大,原子半径:As>P>S,故b错误;c.同周期自左而右非金属性增强,同主族自上而下非金属性减弱,非金属性:S>P>As,故c正确; 故答案为:a c;(3)FeS2水溶液中被O2氧化生成硫酸、氢氧化铁,反应的化学方程式为:4FeS2+15O2+14H2O=4Fe(OH)3+8SO42﹣+16H+ , 故答案为:4FeS2+15O2+14H2O=4Fe(OH)3+8SO42﹣+16H+;(4)投料前水样pH=5.81,0.1mol/LNaClO溶液pH=10.5,溶液中起氧化作用的物质是次氯酸.产生此结果的原因是:起氧化作用的物质是次氯酸,NaClO溶液为碱性,当加入量大时,溶液碱性增强,NaClO溶液浓度增大,水解程度降低,次氯酸不易生成,所以As(Ⅲ)氧化率降低,故答案为:起氧化作用的物质是次氯酸,NaClO溶液为碱性,当加入量大时,溶液碱性增强,NaClO溶液浓度增大,水解程度降低,次氯酸不易生成,所以As(Ⅲ)氧化率降低;(5)pH=6时,NaClO溶液中生成HClO,pH=6时,NaClO氧化亚砷酸(H3AsO3)的离子方程式是:HClO+H3AsO3 =H2AsO4﹣+Cl﹣+2H+ ,
;(2)a.同周期自左而右非金属性增强,最高价氧化物对应水化物酸性增强,同主族自上而下非金属性减弱,最高价氧化物对应水化物酸性减弱,酸性:H2SO4>H3PO4>H3AsO4 , 故a正确;b.同周期自左而右原子半径减小,同主族自上而下原子半径依次增大,原子半径:As>P>S,故b错误;c.同周期自左而右非金属性增强,同主族自上而下非金属性减弱,非金属性:S>P>As,故c正确; 故答案为:a c;(3)FeS2水溶液中被O2氧化生成硫酸、氢氧化铁,反应的化学方程式为:4FeS2+15O2+14H2O=4Fe(OH)3+8SO42﹣+16H+ , 故答案为:4FeS2+15O2+14H2O=4Fe(OH)3+8SO42﹣+16H+;(4)投料前水样pH=5.81,0.1mol/LNaClO溶液pH=10.5,溶液中起氧化作用的物质是次氯酸.产生此结果的原因是:起氧化作用的物质是次氯酸,NaClO溶液为碱性,当加入量大时,溶液碱性增强,NaClO溶液浓度增大,水解程度降低,次氯酸不易生成,所以As(Ⅲ)氧化率降低,故答案为:起氧化作用的物质是次氯酸,NaClO溶液为碱性,当加入量大时,溶液碱性增强,NaClO溶液浓度增大,水解程度降低,次氯酸不易生成,所以As(Ⅲ)氧化率降低;(5)pH=6时,NaClO溶液中生成HClO,pH=6时,NaClO氧化亚砷酸(H3AsO3)的离子方程式是:HClO+H3AsO3 =H2AsO4﹣+Cl﹣+2H+ ,
故答案为:HClO+H3AsO3 =H2AsO4﹣+Cl﹣+2H+ .
(1)磷原子核外电子数为15,有3个电子层,由里到外各层电子数为2、8、5;(2)a.同周期自左而右非金属性增强,最高价氧化物对应水化物酸性增强,同主族自上而下非金属性减弱,最高价氧化物对应水化物酸性减弱;
b.同周期自左而右原子半径减小,同主族自上而下原子半径依次增大;
c.同周期自左而右非金属性增强,同主族自上而下非金属性减弱,非金属性:S>P>As,故c正确;故答案为:ac;(3)FeS2水溶液中被O2氧化生成硫酸、氢氧化铁;(4)图象中曲线变化和溶液浓度越大盐水解程度越小分析;(5)pH=6时,NaClO溶液中生成HClO,图中分析可知pH=6时As(Ⅴ)的存在形式为H2AsO4﹣


科目:高中化学 来源: 题型:
【题目】在一定温度下,10mL 0.40mol/L H2O2溶液发生催化分解,不同时刻测得生成O2的体积(已折算为标准状况)如下表.
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6 min的平均反应速率:v(H2O2)≈3.3×10﹣2 mol/(Lmin)
B.6~10 min的平均反应速率:v(H2O2)<3.3×10﹣2 mol/(Lmin)
C.反应到6 min时,H2O2分解了50%
D.反应到6 min时,c(H2O2)=0.30 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用下图装置探究CO还原Fe2O3所得到的一种黑色粉末的成分(固定装置略去)。(已知:Fe2+遇到K3[Fe(CN)6]溶液生成蓝色沉淀)
请回答问題:
(1)按气流方向,各仪器接口从左到右的连接顺序为:
i→→→g→h→→→j → k→ →。(填字母编号)
(2)证明Fe2O3己被还原的现象是。
(3)研究小组对黑色粉末的成分提出下列猜想:
【猜想一】黑色粉末的成分可能是Fe。
【猜想二】黑色粉末的成分可能是FeO。
【猜想三】黑色粉末的成分可能是。
设计并完成实验如下:
步骤 | 操作 | 现象 |
Ⅰ | 加入稀盐酸 | 溶解,无气泡 |
Ⅱ | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 |
Ⅲ | 变红 |
①根据实验现象,则猜想成立。
②研究小组又向步骤3的溶液中滴加新制氯水,发现溶液红色褪去。可能的原因及验证方法为。
(4)上述装置还有不妥之处,改进措施为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,已知:1molCH4完全燃烧时放出980kJ的热量,1molH2完全燃烧时放出280kJ的热量,现有CH4和H2组成的混合气体共0.4mol,使其在O2中完全燃烧,恢复至常温共放出252kJ的热量,则 CH4与H2的物质的量之比是 ( )
A. 1︰1B. 1︰2C. 2︰3D. 3︰2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行以下实验,能达到实验目的是( )
X | Y | Z | 目的 | 装置 | |
A | 甲苯 | KMnO4溶液 | 稀硫酸 | 证明甲基对苯环的性质存在影响 |
|
B | FeCl3溶液 | KSCN溶液 | 饱和KCl溶液 | 证明增大反应物浓度化学平衡向正反应方向移动 | |
C | 1mol/LNaOH | 1﹣氯丁烷5mL | 2%AgNO3 | 证明1﹣氯丁烷中含有氯元素 | |
D | 0.1mol/LNaCl | 0.1mol/LAgNO3溶液1mL | 0.1mol/LNa2S | 证明AgCl大于Ag2S的溶解度 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国药学家屠呦呦荣获2015年诺贝尔生理学或医学奖,成为首位获得诺贝尔科学类奖项的中国人。获奖理由是她发现了抗疟新药--青蒿素。青蒿素的分子是为C15H22O5 , 常温下是一种无色针状晶片。下列有关说法正确的是( )
屠呦呦领奖图
A.青蒿素属于无机化合物
B.青蒿素属于氧化物
C.标准状况下,1mol青蒿素的体积约为22.4L
D.青蒿素的摩尔质量为282g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色酸性溶液中能大量共存的是( )
A.Cu2+、Mg2+、SO42﹣、NO3﹣
B.K+、Mg2+、SO42+、Cl﹣
C.Ag+、Na+、NO3﹣、Cl﹣
D.NH4+、Ba2+、NO3﹣、OH﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com