
【题目】(1)纯碱(![]() )、小苏打(
)、小苏打(![]() )广泛应用在食品加工。苏打饼干原料中含有小苏打,在烘焙受热过程,小苏打发生分解反应,该反应的化学方程式是______;苏打饼干可以适当缓解人体胃酸(主要成分盐酸)过多症状,该反应的化学方程式是_______。
)广泛应用在食品加工。苏打饼干原料中含有小苏打,在烘焙受热过程,小苏打发生分解反应,该反应的化学方程式是______;苏打饼干可以适当缓解人体胃酸(主要成分盐酸)过多症状,该反应的化学方程式是_______。

(2)某同学利用如图装置(夹持仪器已略去)研究纯碱和小苏打的性质。
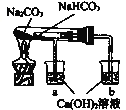
①该实验的目的是_______。
②观察到有白色沉淀生成的烧杯是_________(填字母序号)。
③实验结论是__________。
④为进一步定量研究碳酸氢钠的性质,甲同学用天平准确称量![]() 碳酸氢钠,放入质量为
碳酸氢钠,放入质量为![]() 的坩埚中加热,冷却称量,理论上坩埚及剩余固体的总质量为______
的坩埚中加热,冷却称量,理论上坩埚及剩余固体的总质量为______![]() ,但实际称得的质量比该数值要大,可能的原因是________,改进的操作方法是_______________。
,但实际称得的质量比该数值要大,可能的原因是________,改进的操作方法是_______________。
【答案】2NaHCO3![]() Na2CO3+H2O+CO2↑ NaHCO3+HCl=NaCl+H2O+CO2↑ 探究碳酸钠与碳酸氢钠的热稳定性 b 热稳定性碳酸钠大于碳酸氢钠 42.70 碳酸氢钠没有完全分解或冷却过程中吸收空气的水份 继续加热,在干燥器中冷却后称量,直到质量不再变化为止或放置在干燥器中冷却后称量
Na2CO3+H2O+CO2↑ NaHCO3+HCl=NaCl+H2O+CO2↑ 探究碳酸钠与碳酸氢钠的热稳定性 b 热稳定性碳酸钠大于碳酸氢钠 42.70 碳酸氢钠没有完全分解或冷却过程中吸收空气的水份 继续加热,在干燥器中冷却后称量,直到质量不再变化为止或放置在干燥器中冷却后称量
【解析】
(1)碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,与盐酸反应生成氯化钠、二氧化碳和水,据此书写;
(2)根据装置图可判断实验目的,结合碳酸钠和碳酸氢钠的性质差异、反应的方程式、可能产生的误差原因分析解答。
(1)碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,反应的化学方程式为2NaHCO3![]() Na2CO3+H2O+CO2↑;碳酸氢钠与盐酸反应生成氯化钠、二氧化碳和水,反应的化学方程式为NaHCO3+HCl=NaCl+H2O+CO2↑;
Na2CO3+H2O+CO2↑;碳酸氢钠与盐酸反应生成氯化钠、二氧化碳和水,反应的化学方程式为NaHCO3+HCl=NaCl+H2O+CO2↑;
(2)①根据装置图可知该实验的目的是探究碳酸钠与碳酸氢钠的热稳定性。
②由于碳酸氢钠受热易分解生成二氧化碳、水和碳酸钠,则观察到有白色沉淀生成的烧杯是b。
③根据实验现象可知其实验结论是:热稳定性碳酸钠大于碳酸氢钠。
④8.4g碳酸氢钠的物质的量是8.4g÷84g/mol=0.1mol,根据方程式2NaHCO3![]() Na2CO3+H2O+CO2↑可知固体减少的质量是0.05mol×(18+44)g/mol=3.1g,则理论上坩埚及剩余固体的总质量为8.4g-3.1g+37.40g=42.70g;若实际称得的质量比该数值要大,可能的原因是碳酸氢钠没有完全分解或冷却过程中吸收空气的水份,因此改进的操作方法是继续加热,在干燥器中冷却后称量,直到质量不再变化为止或放置在干燥器中冷却后称量。
Na2CO3+H2O+CO2↑可知固体减少的质量是0.05mol×(18+44)g/mol=3.1g,则理论上坩埚及剩余固体的总质量为8.4g-3.1g+37.40g=42.70g;若实际称得的质量比该数值要大,可能的原因是碳酸氢钠没有完全分解或冷却过程中吸收空气的水份,因此改进的操作方法是继续加热,在干燥器中冷却后称量,直到质量不再变化为止或放置在干燥器中冷却后称量。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】(1)在下列晶体中:①NaOH、②Na2S、③(NH4)2S、④Na2O2、⑤C2H2、⑥SiC。其中既含有离子键又含有非极性共价键的离子晶体是__________;其中既含有离子键,又含有极性共价键和配位键的离子晶体是___________;其中含有极性共价键和非极性共价键的非极性分子是____________;其中属于原子晶体的是____________;
(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。
① 与Fe原子或离子形成配合物的分子或离子都具备的结构特点是_______________;
② 六氰合亚铁离子【Fe(CN)6】4-中的配体CN-中C原子的杂化轨道类型是________,写出一种与CN互为等电子体的单质分子的结构式_______;
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华。易溶于水,也易溶于乙醚.丙酮等有机溶剂。据此判断三氯化铁晶体类型为_________________;
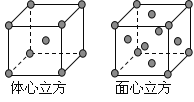
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关胶体的叙述正确的是( )
A. 直径介于1-100nm之间的微粒称为胶体
B. 有色玻璃、雾都不是胶体
C. 涂料、颜料、墨水的制造,明矾净水和胶体有关
D. 硅酸胶体加入过量的氢氧化钠溶液由于胶体聚沉而形成硅酸沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池作为安全性能较好的一类化学电源得到了更快的发展,一种以联氨(N2H4)为燃料的环保电池工作原理如图所示,工作时产生稳定无污染的物质。下列说法正确的是
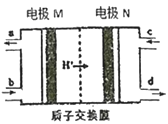
A. M极生成氮气且电极附近pH降低
B. 负极上每消耗1 mol N2H4,会有2 molH+通过质子交换膜
C. 正极的电极反应式为:O2+2H2O+4e-=4OH-
D. 电极M是原电池的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是( )
A. 大理石溶于醋酸中:CaCO3+2H+═Ca2++CO2↑+H2O
B. 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+
C. MnO2与浓盐酸反应制Cl2:MnO2+4H++4Cl﹣![]() Mn2++2Cl2↑+2H2O
Mn2++2Cl2↑+2H2O
D. 浓硝酸中加入过量铁粉并加热:Fe+3NO3﹣+6H+![]() Fe3++3NO2↑+3H2O
Fe3++3NO2↑+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用下列实验探究金属铝与铜盐溶液的反应:
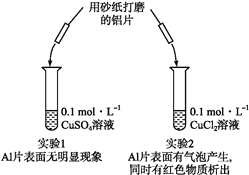
下列说法正确的是( )
A. 由实验1可以得出结论:金属铝的活泼性弱于金属铜
B. 实验2中生成红色物质的离子方程式为Al+Cu2+![]() Al3++Cu
Al3++Cu
C. 溶液中阴离子种类不同是导致实验1、2出现不同现象的原因
D. 由上述实验可推知:用砂纸打磨后的铝片分别与H+浓度均为0.2 mol·L-1的盐酸和硫酸溶液反应,后者更剧烈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. ![]() 和
和![]() 互为同素异形体 B. 红磷和白磷互为同位素
互为同素异形体 B. 红磷和白磷互为同位素
C. 邻二甲苯和对二乙苯互为同系物 D. CH3C(CH3)2CH3和![]() 互为同分异构体
互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应N2(g)+3H2(g) ![]() 2NH3(g) △H<0.达到平衡后,以下分析正确的是
2NH3(g) △H<0.达到平衡后,以下分析正确的是
A. 增大压强,对正反应的反应速率影响更大
B. 升高温度,对正反应的反应速率影响更大
C. 减小反应物浓度,对逆反应的反应速率影响更大
D. 加入催化剂,对逆反应的反应速率影响更大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L的恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g)![]() 2C(g)+D(s) △H=a kJ·mol-1,实验内容和结果分别如表和图所示,下列说法不正确的是
2C(g)+D(s) △H=a kJ·mol-1,实验内容和结果分别如表和图所示,下列说法不正确的是
实验序号 | 温度 | 起始物质的量 | 热量变化 | |
A | B | |||
I | 600℃ | 1mol | 3mol | 96kJ |
II | 800℃ | 1.5mol | 0.5mol | —— |
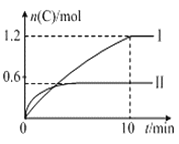
A. 实验Ⅰ中,10 min内平均速率v(B)=0.03 mol·L-1·min-1
B. 上述方程式中a=160
C. 600 ℃时,该反应的平衡常数是1.5
D. 向实验Ⅱ的平衡体系中再充入0.5 mol A和1.5 mol B,A的转化率增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com