
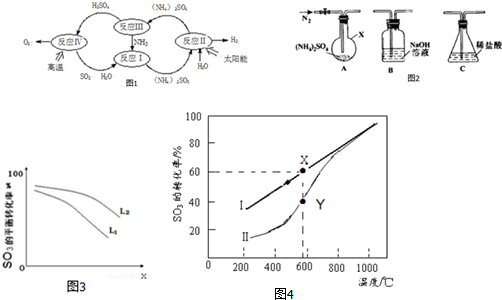
分析 (1)据图分析,反应Ⅱ是太阳能转化为电能,电解亚硫酸铵生成硫酸铵和氢气,
(2)反应Ⅲ分析可知,不同条件下硫酸铵分解产物不同,(NH4)2SO4在400℃分解时,有NH3、SO2、H2O生成,S元素化合价降低,根据电子转移守恒,只能为N元素化合价升高,气体产物中无氮氧化物,说明生成N2,配平书写方程式;
(3)①i.由图可知,X.越大,转化率越低;
ii.分解反应为吸热反应,温度高,转化率大;
②a.2H2SO4(l)═2SO2(g)+O2(g)+2H2O(l)△H=+462kJ/mol,
b.H2SO4(l)═SO3(g)+H2O(g)△H=+177kJ/mol
c.H2O(l)═H2O(g)△H=+44kJ/mol
盖斯定律计算2c+a-2b得到SO3(g)分解的热化学方程式;
(4)①恒温密闭容器中,控制不同温度进行SO3分解实验.SO3起始浓度均为 cmol•L-1,测定SO3的转化率在X点为60%,结合平衡三行计算得到平衡浓度计算得到平衡常数;
②Y点时反应还没有达到平衡状态,正向进行;温度的升高,曲线b向曲线a逼近,反应速率加快.
解答 解:(1)反应Ⅱ是太阳能转化为电能,电解亚硫酸铵生成硫酸铵和氢气,阳极上是亚硫酸根离子得到电子生成硫酸根离子,电极反应为:SO32--2e-+H2O=SO42-+2H+,
故答案为;SO32--2e-+H2O=SO42-+2H+;
(2)分析可知,(NH4)2SO4在400℃分解时,有NH3、SO2、H2O生成,S元素化合价降低,根据电子转移守恒,只能为N元素化合价升高,气体产物中无氮氧化物,说明生成N2,分解反应方程式为:3(NH4)2SO4$\frac{\underline{\;600℃\;}}{\;}$4NH3↑+3SO2↑+6H2O↑+N2↑,
故答案为:3(NH4)2SO4$\frac{\underline{\;600℃\;}}{\;}$4NH3↑+3SO2↑+6H2O↑+N2↑;
(3)①i.由图可知,X越大,转化率越低,升高温度转化率增大,则X表示压强,故答案为:压强;
ii.由2SO3(g)=2SO2(g)+O2(g)△H>0,在压强相同的情况下,温度高,转化率大,图中等压强时L2对应的转化率大,则L1<L2,
故答案为:L1<L2 SO3分解吸热,在压强相同的情况下,随温度的升高,SO3的转化率增大;
②a.2H2SO4(l)═2SO2(g)+O2(g)+2H2O(l)△H=+462kJ/mol,
b.H2SO4(l)═SO3(g)+H2O(g)△H=+177kJ/mol
c.H2O(l)═H2O(g)△H=+44kJ/mol
盖斯定律计算2c+a-2b得到SO3(g)分解的热化学方程式为2SO3(g)=2SO2(g)+O2(g)△H=+196kJ•mol-1,
故答案为:2SO3(g)═2SO2(g)+O2(g)△H=+196kJ/mol;
(4)①恒温密闭容器中,控制不同温度进行SO3分解实验.SO3起始浓度均为 cmol•L-1,测定SO3的转化率在X点为60%,
2SO3(g)=2SO2(g)+O2(g)
起始量(mol) c 0 0
转化量(mol)0.6c 0.6c 0.3c
平衡量(mol)c-0.6c 0.6c 0.3c
平衡常数K=$\frac{0.3c×(0.6c)^{2}}{(0.4c)^{2}}$=0.675c,
故答案为:0.675c;
②Y点时反应还没有达到平衡状态,正向进行,所以正反应速率大于逆反应速率,温度的升高,曲线b向曲线a逼近,反应速率加快,达到平衡时的时间缩短,
故答案为:>;温度升高,反应速率加快,达到平衡所需要的时间缩短;
点评 本题考查学生根据图象获取信息的能力,涉及电极式的书写、化学反应速率、化学平衡影响因素、平衡常数计算、盖斯定律等,综合知识的应用,题目难度中等.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸滤既能加快过滤速率和得到更干燥的沉淀,又能使沉淀颗粒变粗变大 | |
| B. | 在“阿司匹林的合成”实验中,把从盐酸中析出的晶体进行抽滤,用酒精洗涤晶体1~2次,然后抽滤,将晶体转移到表面皿上,干燥后称其质量,计算产率 | |
| C. | 记录Na2S2O3与稀硫酸的反应时间,应从溶液混合时开始计时,到刚出现浑浊结束 | |
| D. | 硫酸亚铁铵晶体过滤后用无水乙醇洗涤而不要用水洗涤主要是为了减少晶体损失 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酸性高锰酸钾溶液鉴别苯、甲苯和环己烯 | |
| B. | 用燃烧法鉴别乙醇、苯和四氯化碳 | |
| C. | 用水鉴别乙醇、甲苯和溴苯 | |
| D. | 用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
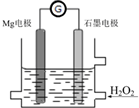 Mg-H2O2电池是一种化学电源,以Mg和石墨为电极,海水为电解质溶液,示意图如下.下列说法不正确的是( )
Mg-H2O2电池是一种化学电源,以Mg和石墨为电极,海水为电解质溶液,示意图如下.下列说法不正确的是( )| A. | 镁电极是该电池的负极 | |
| B. | 石墨电极上发生还原反应 | |
| C. | Mg电极的电极反应式:Mg-2e-═Mg2+ | |
| D. | 电池工作时,电子从石墨电极经导线流向Mg电极,溶液中阳离子流向正极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com