
【题目】下图是工业上铝土矿(含有Al2O3和Fe2O3等)冶炼铝的工艺流程图:

(1)操作①的名称是:___________。操作①剩余的矿渣主要成分为:__________(填化学式)。
(2)图中①为了提高NaOH和铝土矿的反应速率可采取哪些措施__________________________(写两条)。
(3)图中①的离子方程式_____________________________________________________________;图中③、④的化学反应方程式______________________________________________________。
(4)洗涤Al(OH)3沉淀的具体操作是: ________________________________________。
【答案】过滤 Fe2O3 适当提高温度、粉碎、搅拌、适当提高氢氧化钠的浓度等; Al2O3+2OH-=2AlO2-+H2O 2Al(OH)3![]() Al2O3+3H2O 2Al2O3(熔融)
Al2O3+3H2O 2Al2O3(熔融)![]() 4Al+3O2↑ 沿玻璃棒向漏斗中加蒸馏水至刚好浸没沉淀,待水自然流尽,重复2~3次
4Al+3O2↑ 沿玻璃棒向漏斗中加蒸馏水至刚好浸没沉淀,待水自然流尽,重复2~3次
【解析】
(1)不溶于水的固体和液体,可用过滤的方法分离;Fe2O3溶于强酸,不溶于碱,则在①得到滤渣为氧化铁;
(2)从影响化学反应速率的因素解析。
(3)向铝土矿中加入足量烧碱溶液后,氧化铝是两性氧化物,既溶液强酸又溶于强碱.Al(OH)3受热分解;电解熔融的氧化铝制铝。
(4)按沉淀洗涤的要求回答。
(1)分离不溶于水的固体和液体,可用过滤的方法;Fe2O3溶于强酸,不溶于碱,则在①得到滤渣为氧化铁;
(2)图中①为了提高NaOH和铝土矿的反应速率可采取:适当提高温度、粉碎、搅拌、适当提高氢氧化钠的浓度等;
(3)向铝土矿中加入足量烧碱溶液后,氧化铝是两性氧化物,既溶液强酸又溶于强碱,发生反应的化学方程式为Al2O3+2NaOH═2NaAlO2+H2O,离子方程式为Al2O3+2OH-=2AlO2-+H2O;Al(OH)3受热分解,2Al(OH)3![]() Al2O3+3H2O;电解熔融的氧化铝制铝,2Al2O3(熔融)
Al2O3+3H2O;电解熔融的氧化铝制铝,2Al2O3(熔融)![]() 4Al+3O2↑。
4Al+3O2↑。
(4)洗涤Al(OH)3沉淀的具体操作是:沿玻璃棒向漏斗中加蒸馏水至刚好浸没沉淀,待水自然流尽,重复2~3次。


 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】通常状况下,CO是一种无色、无味、有毒的气体,难溶于水,与酸、碱、盐溶液均不反应。已知乙二酸晶体加热分解的方程式为:H2C2O4·2H2O![]() 3H2O+CO2↑+CO↑,不考虑其他因素干扰,如何利用下列装置验证反应产物中含有CO2和CO(装置不能重复使用)。酒精喷灯可作高温热源。请回答下列问题:
3H2O+CO2↑+CO↑,不考虑其他因素干扰,如何利用下列装置验证反应产物中含有CO2和CO(装置不能重复使用)。酒精喷灯可作高温热源。请回答下列问题:
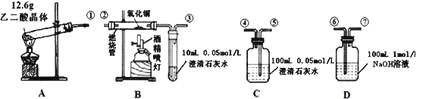
(1)检验装置A气密性的方法是
(2)按气流方向连接各仪器,用数字表示接口的连接顺序:
①→
(3)证明CO存在的实验现象是
(4)本实验尾气处理的方法是
(5)根据题给的数据,假设各反应均充分发生且产生的气体全部排出,并与吸收液充分反应(提示:B、C中澄清石灰水均先变浑浊,后又变澄清),D中溶质及对应的物质的量是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:(1)Zn(s)+1/2O2(g)=ZnO(s) △H=-348.3kJ·mol-1 ,
(2)2Ag(s)+1/2O2(g)=Ag2O(s) △H=-31.0kJ·mol-1,
则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△H等于
A. -317.3kJ·mol-1 B. -379.3kJ·mol-1 C. -332.8kJ·mol-1 D. +317.3kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们利用原电池原理制作了多种电池,以满足日常生活、生产和科学技术等方面的需要。请根据题中提供的信息,回答下列问题。
(1)铅蓄电池在放电时的电池反应为![]() ,则其正极上的电极反应为_____。
,则其正极上的电极反应为_____。
(2)![]() 溶液腐蚀印刷电路铜板时发生反应:
溶液腐蚀印刷电路铜板时发生反应:![]() 。若将此反应设计成原电池,则负极所用的电极材料为_____;电极反应式:____;当电路中转移0.2mol电子时,被腐蚀的铜的质量为_____g。
。若将此反应设计成原电池,则负极所用的电极材料为_____;电极反应式:____;当电路中转移0.2mol电子时,被腐蚀的铜的质量为_____g。
(3)已知甲醇燃料电池的工作原理如图所示。该电池工作时,b口通入的物质为___,该电池正极上的电极反应式为__;当6.4g甲醇(![]() )完全反应生成
)完全反应生成![]() 时,有___mol电子发生转移。
时,有___mol电子发生转移。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应在任何温度下均能自发进行的是
A. 2N2(g)+O2(g)===2N2O(g) ΔH=+163 kJ·mol-1
B. Ag(s)+Cl2(g)===AgCl(s) ΔH=-127 kJ·mol-1
C. HgO(s)===Hg(l)+O2(g) ΔH=+91 kJ·mol-1
D. H2O2(l)===O2(g)+H2O(l) ΔH=-98 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,其性质和制备受到人们的关注。一定温度下,在2 L固定容积的密闭容器中发生反应:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列正确的是( )
4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列正确的是( )

A. 0-20 s内平均反应速率v(N2O5)="0.1" mol·L-1·s-1
B. 10 s时,正、逆反应速率相等,达到平衡
C. 20 s时,正反应速率大于逆反应速率
D. 曲线a表示NO2的物质的量随反应时间的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式不正确的是
A. 少量SO2气体通入次氯酸钠溶液中:SO2+3ClO-+H2O=SO42-+Cl-+2HClO
B. 氧化铁溶于HI溶液:Fe2O3+6H+=2Fe3++3H2O
C. 碳酸氢钠与过量Ba(OH)2溶液反应:HCO3-+OH-+Ba2+=BaCO3![]() +H2O
+H2O
D. 向硅酸钠水溶液中通入过量CO2气体:SiO32-+2H2O+2CO2=2HCO3-+H2SiO3![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com