
【题目】在氢氟酸溶液中,存在如下电离平衡:HFH++F-
(1)加入固体NaOH,电离平衡向______反应方向移动,c(H+)______ .
(2)加入固体NaF,电离平衡向______反应方向移动.
(3)升高温度,电离平衡向______反应方向移动.
(4)常温下,小苏打溶液呈______性,原因是_________________________(用必要的离子方程式及文字解释表示).
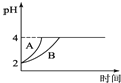
(5)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示,则图中表示醋酸溶液中pH变化曲线的是 ______(填“A”或“B”);设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2则m1______m2(选填“>”、“=”“<”)
【答案】正 减小 逆 正 碱 在NaHCO3溶液中存在:HCO3-![]() H++CO32-、HCO3-+H2O
H++CO32-、HCO3-+H2O![]() H2CO3+OH-,由于HCO
H2CO3+OH-,由于HCO![]() 的水解程度大于电离程度,溶液呈碱性 B <
的水解程度大于电离程度,溶液呈碱性 B <
【解析】
在氢氟酸溶液中,存在如下电离平衡:HFH++F-,
(1)加入氢氧化钠固体,氢氧化钠和氢离子反应生成水,氢离子浓度减小,电离平衡向正反应方向移动;
(2)向溶液中加入氟化钠固体,氟离子浓度增大,抑制氢氟酸电离,电离平衡向逆反应方向移动;
(3)弱电解质的电离是吸热的,升高温度,促进氢氟酸电离,电离平衡向正反应方向移动;
(4)在NaHCO3溶液中存在:HCO3-H++CO32-、HCO3-+H2OH2CO3+OH-,由于HCO![]() 的水解程度大于电离程度,因此小苏打溶液呈碱性;
的水解程度大于电离程度,因此小苏打溶液呈碱性;
(5)醋酸为弱酸,等pH时,醋酸浓度较大,与锌反应时,醋酸进一步电离出氢离子,则醋酸的pH变化较小,醋酸中存在电离平衡,氢离子和锌反应时促进醋酸电离,补充反应的氢离子,pH变化等量时,消耗的锌较多,以此解答。
在氢氟酸溶液中,存在如下电离平衡:HFH++F-,
(1)加入氢氧化钠固体,氢氧化钠和氢离子反应生成水,氢离子浓度减小,电离平衡向正反应方向移动,但溶液中氢离子浓度减小;
故答案为:正;减小;
(2)向溶液中加入氟化钠固体,氟离子浓度增大,抑制氢氟酸电离,电离平衡向逆反应方向移动;
故答案为:逆;
(3)弱电解质的电离是吸热的,升高温度,促进氢氟酸电离,电离平衡向正反应方向移动;
故答案为:正;
(4)在NaHCO3溶液中存在:HCO3-H++CO32-、HCO3-+H2OH2CO3+OH-,由于HCO![]() 的水解程度大于电离程度,因此小苏打溶液呈碱性;
的水解程度大于电离程度,因此小苏打溶液呈碱性;
故答案为:碱;在NaHCO3溶液存在中:HCO3-H++CO32-、HCO3-+H2OH2CO3+OH-,由于HCO![]() 的水解程度大于电离程度,溶液呈碱性;
的水解程度大于电离程度,溶液呈碱性;
(5)由于醋酸是弱电解质,与Zn反应同时,电离出H+,所以pH变化较缓慢,所以B曲线是醋酸溶液的pH变化曲线;由图知盐酸和醋酸的pH变化都是由2到4,盐酸中氢离子浓度逐渐减小,但醋酸中存在电离平衡,氢离子和锌反应时促进醋酸电离,补充反应的氢离子,所以醋酸是边反应边电离H+,故消耗的Zn多,所以m1<m2;
故答案为:B;<。


科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( )
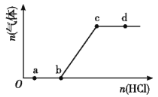
A.a点对应的溶液中:Na+、OH-、SO42-、NO3-
B.b点对应的溶液中:K+、Ca2+、H+、Cl-
C.c点对应的溶液中:Na+、Ca2+、NO3-、Cl-
D.d点对应的溶液中:F-、NO3-、Fe2+、Ag+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,CaCO3在水中的沉淀溶解平衡曲线如图所示。已知CaCO3的溶度积(室温)为2.8×10-9,下列说法中不正确的是

A. x的数值为2×10-5
B. c点时有CaCO3生成
C. 加入蒸馏水可使溶液由d点变成 a点
D. b点与d点对应的溶度积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合下表回答下列问题:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
溶度积/25 ℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
现有某酸性CuCl2溶液中含有少量的FeCl2,为得到纯净的CuCl2·2H2O晶体,按如图步骤进行提纯:
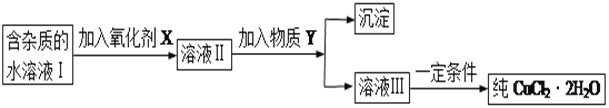
(1)最适合作氧化剂X的是_________(填字母),加入X的目的是____________________________________。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物质Y是____________(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=____________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是______________________________________________________。
(3)含Cr2O![]() 的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O![]() ,为了使废水的排放达标,进行如下处理:
,为了使废水的排放达标,进行如下处理:
![]()
①绿矾化学式为FeSO4·7H2O,反应(I)的离子方程式为________________________________;
②若处理后的废水中c(Cr3+)=3.0×10-6 mol·L-1,则废水中c(Fe3+)= _________ mol·L-1。(Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH) 3]=6.0×10-31)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,HF的电离常数Ka=6.61×10-4,NH3﹒H2O电离常数Kb=1.78×10-5。下列说法正确的是
A.NH4F溶液中![]()
B.NH4F溶液中水的电离程度小于纯水的电离程度
C.NH4F溶液中F-的水解平衡常数Kh(F-)=1.51×10-11
D.NH4F与NH4Cl的混合溶液中有下列关系:c(NH4+)>c(F-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈___(填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+)___c(CH3COO-)(填“>”或“=”或“<”)。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈___,溶液中c(Na+)___c(CH3COO-)。
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈___,醋酸体积___氢氧化钠溶液体积。
(4)常温下,Ksp(PbI2)=8.5×10-9。取适量黄色PbI2粉末溶于水中,充分揽拌后得到浊液,过滤。在滤液中加入少量KI,测得c(I-)=1.0×10-2mol·L-1。则c(Pb2+)=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于下列化学平衡在一定条件下发生移动的描述,不正确的是
A.Cl2+H2O![]() HCl+HClO,氯水中加入碳酸钙,漂白性增强
HCl+HClO,氯水中加入碳酸钙,漂白性增强
B.ZnS + Cu2+![]() CuS + Zn2+,闪锌矿(ZnS)遇CuSO4溶液转化为铜蓝(CuS)
CuS + Zn2+,闪锌矿(ZnS)遇CuSO4溶液转化为铜蓝(CuS)
C.2NO2![]() N2O4 ΔH<0,将装有NO2的玻璃球浸入热水中,红棕色变浅
N2O4 ΔH<0,将装有NO2的玻璃球浸入热水中,红棕色变浅
D.Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色) +2H+,K2Cr2O7溶液中滴加几滴浓硫酸,橙色加深
2CrO42-(黄色) +2H+,K2Cr2O7溶液中滴加几滴浓硫酸,橙色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气是一种更优良的燃料,但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:______。
(2)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为______,热化学方程式如反应①所示,此外反应②③也可以获取![]() 。
。
①太阳光催化分解水制氢:![]()
![]()
②焦炭与水反应制氢:![]()
![]()
③甲烷与水反应制氢:![]()
则反应![]() 的
的![]() ______。
______。
(3)在恒温恒容的密闭容器中,某储氢反应:![]() 达到化学平衡。下列有关叙述正确的是______。
达到化学平衡。下列有关叙述正确的是______。
![]() 若向答器内再加入少量
若向答器内再加入少量![]() ,则
,则![]() 转化率增大
转化率增大
![]() 使用催化剂可以加快反应速率,提高生产效率
使用催化剂可以加快反应速率,提高生产效率
![]() 吸收
吸收![]() 只需
只需![]()
![]() 容器内气体压强保持不变
容器内气体压强保持不变
(4)氢气可与氧气直接化合制备过氧化氢,是一种具有环保意义的直接、简便和经济的合成过氧化氢的方法;其工艺特点主要采用水作反应介质,活性炭为载体的![]() 催化剂,还有适当的助剂。合成时在反应物中加入稀释剂。如
催化剂,还有适当的助剂。合成时在反应物中加入稀释剂。如![]() 、
、![]() 或Ar,请说出需要加入稀释剂的原因______;另外在此法合成过氧化氢的过程中容易发生一些副反应导致产率的降低,请写出一个副反应的化学方程式______。
或Ar,请说出需要加入稀释剂的原因______;另外在此法合成过氧化氢的过程中容易发生一些副反应导致产率的降低,请写出一个副反应的化学方程式______。
(5)长征五号系列运载火箭,又称:“大火箭”、“冰箭”,是我国研制的一次性大型低温液体运载火箭,火箭使用了以液氢为燃烧剂,被氧为氧化剂的高能推进剂。已知:
①![]()
②![]()
③有关过程如图:
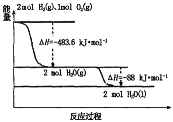
请写出火箭液氢燃烧的热化学方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于放热反应的是
A.2Na +2H2O = 2NaOH + H2↑
B.CaCO3![]() CaO +CO2↑
CaO +CO2↑
C.C + H2O![]() CO + H2
CO + H2
D.2NH4Cl + Ba(OH)2·8H2O = BaCl2+2NH3↑+10H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com