
| A、0.3mol/L |
| B、0.03mol/L |
| C、3mol/L |
| D、0.4mol/L |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
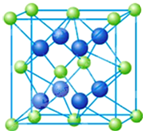 X、Y、W、M、N五种元素分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X和Y的氢化物都比同族元素氢化物的沸点高,但在同周期中却不是最高的.W是同周期元素中离子半径最小的元素.M属s区元素,M原子的最外能层上有两个运动状态不同的电子.N是一种“明星金属”,广泛应用于航天、军事等工业领域.请回答下列问题:
X、Y、W、M、N五种元素分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X和Y的氢化物都比同族元素氢化物的沸点高,但在同周期中却不是最高的.W是同周期元素中离子半径最小的元素.M属s区元素,M原子的最外能层上有两个运动状态不同的电子.N是一种“明星金属”,广泛应用于航天、军事等工业领域.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2mol | B、2.5mol |
| C、4mol | D、5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5:4 | B、4:5 |
| C、5:12 | D、12:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能说明盐酸是强酸:2HCl+CaCO3=CaCl2+CO2↑+H2O |
| B、能说明NH3结合H+能力比H2O强:NH3+H3O+=NH4++H2O |
| C、能说明CH3COOH是弱电解质:CH3COO-+H2O?CH3COOH+OH- |
| D、铅蓄电池放电时正极发生如下反应,说明氧化性PbO2>Pb:PbO2+4H++SO42-+2e-=PbSO4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
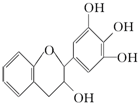 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中不正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中不正确的是( )| A、遇FeCl3溶液发生显色反应 |
| B、易发生氧化反应和取代反应,较难发生加成反应 |
| C、可与碳酸氢钠溶液反应放出CO2气体 |
| D、1mol EGC与4mol NaOH恰好完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5mol/L氯化铵 |
| B、0.5mol/L氨水 |
| C、0.5mol/L H2SO4 |
| D、0.5mol/L盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuSO4溶液与锌粉反应:Cu2++Zn=Zn2++Cu |
| B、碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑ |
| C、金属钠投入水中:Na+H2O=Na++OH-+H2↑ |
| D、稀H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com