
【题目】神舟十一号飞船搭乘CZ—2F火箭成功发射,在重达495吨的起飞重量中,95%的都是化学推进剂。
(1)CH3OH和液氧是常用的液体火箭推进剂。
①已知:
CO2(g)+3H2(g)CH3OH(g)+H2O(l) ΔH1
2H2(g)+O2(l)=2H2O(l) ΔH2
CH3OH(g)=CH3OH(l) ΔH3
2CH3OH(l)+3O2(l)=2CO2(g)+4H2O(l) ΔH4
则ΔH4=______(用ΔH1、ΔH2、ΔH3来表示)。
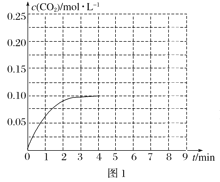
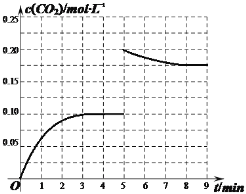
②某温度下,发生反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)。在体积为2L的密闭容器中加入1molCH3OH和1molH2O,第4min达到平衡,容器内c(CO2)随时间的变化情况如图1所示,求此反应在该温度下的平衡常数______(保留四位有效数字)。保持其他条件不变,在第5min时向体系中再充入0.2molCO2和0.4molH2,第8min重新达到平衡,此时c(H2)=c(CH3OH)。请在图1中画出5~9min的c(CO2)变化曲线示意图_______。
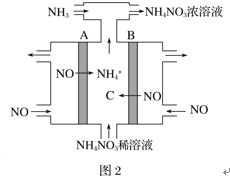
(2)NH4NO3也是一种重要的固体推进剂,可通过电解NO制备NH4NO3,其工作原理如图2所示,A电极的名称为______极,请写出在B电极上发生的电极反应式:______。
【答案】3△H22△H12△H3 59.26 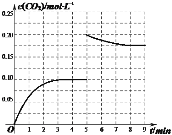 阴 NO3e+2H2O=NO3+4H+
阴 NO3e+2H2O=NO3+4H+
【解析】
(1)①利用盖斯定律:3×②-2×①-2×③得,2CH3OH(l)+3O2(l)═2CO2(g)+4H2O(l)△H4=3△H2-2△H1-2△H3,据此进行分析;
②CO2(g)+3H2(g) CH3OH(g)+H2O(g),据K=![]() 进行计算;反应物浓度增大,使平衡不断向正反应方向进行,据此作图;
进行计算;反应物浓度增大,使平衡不断向正反应方向进行,据此作图;
(2)由图可知,A极上NO生成NH4+,发生还原反应,为电解池阴极,B极上NO生成NO3-,发生氧化反应,据此书写电极反应方程式。
(1)①已知:①CO2(g)+3H2(g) CH3OH(g)+H2O(l) ΔH1
②2H2(g)+O2(l)=2H2O(l) ΔH2
③CH3OH(g)=CH3OH(l) ΔH3
2CH3OH(l)+3O2(l)=2CO2(g)+4H2O(l) ΔH4
根据盖斯定律,3×②2×①2×③得,2CH3OH(l)+3O2(l)═2CO2(g)+4H2O(l)△H4=3△H22△H12△H3;
②根据题意,列三段式:
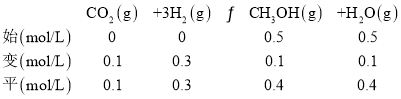
K=![]() ,反应物浓度增大,使平衡不断向正反应方向进行,故图为
,反应物浓度增大,使平衡不断向正反应方向进行,故图为
 ,
,
(3)由图可知,A极上NO生成NH4+,发生还原反应,为电解池阴极;B极上NO生成NO3,发生氧化反应,故电极反应方程式为NO3e+2H2O=NO3+4H+。


科目:高中化学 来源: 题型:
【题目】在铜、锌、稀硫酸构成的原电池中(如图所示)
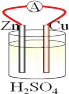
(1)负极是__________(填“铜”或“锌”),_________电子(填“失去”或“得到”),发__________(填“氧化”或 “还原”),电极反应方程式______________;
(2)电流由__________流向__________(填“铜”或“锌),铜片上观察到的现象是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放SO2、NO2会危害环境。工业上常采用化学方法控制污染。
(1)下图是1mol CH4完全燃烧生成气态水的能量变化和1molS(g)燃烧的能量变化。

①CH4完全燃烧的活化能是_____________kJ/mol
②在催化剂作用下,CH4可以还原SO2生成单质S(g)、H2O(g)和CO2,写出该反应的热化学方程式_____________________________;
(2)为减少SO2排放,将含SO2的烟气通过洗涤剂X,充分吸收后再向吸收后的溶液中加入稀硫酸,既可以回收![]() ,同时又可得到化肥。X可以是__________(填序号)。
,同时又可得到化肥。X可以是__________(填序号)。
a.Ca(OH)2 b.K2CO3 c.Na2SO3 d.NH3H2O
(3)对NO2+SO2![]() SO3+NO △H<0反应进行探究:在固定体积的密闭容器中,使用某种催化剂,改变原料气配比进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率。实验结果如图所示:
SO3+NO △H<0反应进行探究:在固定体积的密闭容器中,使用某种催化剂,改变原料气配比进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率。实验结果如图所示:

①能够加快该化学反应速率的外界条件是___________________
a.降低温度 b.增大压强 c.升高温度 d.减小压强
②如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是___________;
③若A点对应实验中,SO2(g)的起始浓度为c0mol/L,经过![]() min达到平衡状态,该时段化学反应速率v(NO2)___mol/(Lmin);
min达到平衡状态,该时段化学反应速率v(NO2)___mol/(Lmin);
④图中C、D两点对应的实验温度分别为![]() 和
和![]() ,计算判断
,计算判断![]() ______
______![]() (填>、=、或<)
(填>、=、或<)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 0.1000 mol·L-1NaOH溶液滴定 20.00mL某未知浓度的CH3COOH溶液,滴定曲线如图所示。已知在点③处恰好中和。下列说法错误的是
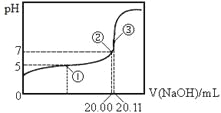
A.该温度下CH3COOH的电离平衡常数约为1.8 ×10-5
B.点①处溶液中c(CH3COO-)<c(CH3COOH)
C.点③处溶液中c(OH-)= c(CH3COOH)+c(H+)
D.滴定过程中不可能出现:c(CH3COOH) >c(CH3COO-)> c(OH-)> c(Na+)> c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项反应对应的图象错误的是![]()
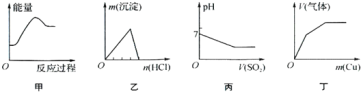
A.图甲:将氮气和氧气混合后在放电条件下反应
B.图乙:将稀盐酸逐滴加入一定量偏铝酸钠溶液中
C.图丙:将二氧化硫逐渐通入一定量氯水中
D.图丁:将铜粉逐渐加入一定量浓硝酸中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下图1所示是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
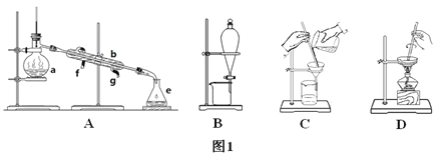
(1)从氯化钾溶液中得到氯化钾固体选择装置________(填代表装置图的字母,下同);除去自来水中的氯离子等杂质选择装置________。
(2)从碘水中分离出I2选择装置________,该分离方法的名称为________。
Ⅱ.海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如图2流程的实验:
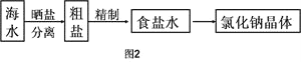
(3)粗盐中含![]() 等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有: ①加入过量的Na2CO3溶液②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④加入盐酸调节溶液至中性;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是(填写序号字母)_________________。
等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有: ①加入过量的Na2CO3溶液②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④加入盐酸调节溶液至中性;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是(填写序号字母)_________________。
A.⑤②③①④⑥⑦ B.⑤①②③⑥④⑦ C.⑤②①③④⑥⑦ D.⑤③②①⑥④⑦
(4)写出上述实验步骤中加入过量的Na2CO3溶液时发生反应的离子方程式:______________________,_______________________。
(5)由海水到氯化钠晶体的实验过程中要用到的主要装置是(从图1中给定的四种装置中选择)______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室验证钠能与二氧化碳发生反应,并确定其产物的装置如图所示(已知:PdC12溶液遇CO能产生黑色的Pd),下列说法错误的是

A. 装置①的仪器还可以制取H2、NH3等气体
B. 装置⑤中石灰水变浑浊后,再点燃酒精灯
C. 装置②③中分别盛装饱和Na2CO3溶液、浓H2SO4
D. 装置⑥中有黑色沉淀,发生的反应是PdC12+CO+H2O=Pd↓+CO2+2HC1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究小组探究外界条件对化学反应mA(g)+nB(g)![]() pC(g)的速率和平衡的影响,图像如下,下列判断正确的是( )
pC(g)的速率和平衡的影响,图像如下,下列判断正确的是( )

A. 由图a可知,T1>T2,该反应的逆反应为吸热反应
B. 由图b可知,该反应m+n<p
C. 图c是绝热条件下速率和时间的图像,由此说明该反应吸热
D. 图d中,若m+n=p,则曲线a一定增大了压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示仪器可用于实验室制备少量无水![]() ,仪器连接顺序正确的是( )
,仪器连接顺序正确的是( )
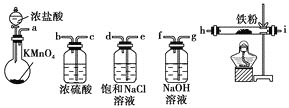
A.a→b→c→d→e→i→h→fB.a→e→d→c→b→h→i→g
C.a→d→e→c→b→h→i→gD.a→c→b→d→e→h→i→f
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com