
【题目】Ⅰ.下图1所示是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
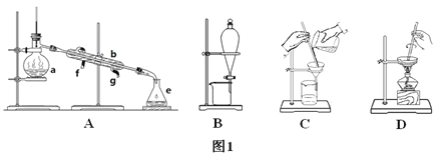
(1)从氯化钾溶液中得到氯化钾固体选择装置________(填代表装置图的字母,下同);除去自来水中的氯离子等杂质选择装置________。
(2)从碘水中分离出I2选择装置________,该分离方法的名称为________。
Ⅱ.海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如图2流程的实验:
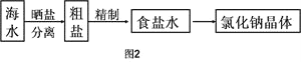
(3)粗盐中含![]() 等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有: ①加入过量的Na2CO3溶液②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④加入盐酸调节溶液至中性;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是(填写序号字母)_________________。
等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有: ①加入过量的Na2CO3溶液②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④加入盐酸调节溶液至中性;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是(填写序号字母)_________________。
A.⑤②③①④⑥⑦ B.⑤①②③⑥④⑦ C.⑤②①③④⑥⑦ D.⑤③②①⑥④⑦
(4)写出上述实验步骤中加入过量的Na2CO3溶液时发生反应的离子方程式:______________________,_______________________。
(5)由海水到氯化钠晶体的实验过程中要用到的主要装置是(从图1中给定的四种装置中选择)______________________。
【答案】D A B 萃取、分液 d ![]()
![]() CD
CD
【解析】
Ⅰ.(1)从溶液中得到固体采用蒸发结晶的方法;除去自来水中的Cl-等杂质采用蒸馏的方法;
(2)从碘水中分离出I2,碘易溶于有机溶剂而难溶于水,所以可以采用萃取方法;
Ⅱ.(3)粗盐中含Ca2+、Mg2+、SO42-等杂质,提纯过程中,先加水溶解,然后把杂质转化为沉淀或气体除去,除Ca2+用CO32-,除Mg2+用OH-,除SO42-用Ba2+.要注意除杂质的顺序,后加的试剂最好能把前面先加的过量试剂除掉;
(4)实验步骤中加入过量的Na2CO3溶液的目的是除去溶液中的Ca2+和过量的Ba2+;
(5)由海水到氯化钠晶体的实验过程中先沉淀杂质离子,然后过滤最后蒸发浓缩。
A为蒸馏装置,B为分液装置,C为过滤装置,D为蒸发结晶装置;
Ⅰ.(1)从溶液中得到固体采用蒸发结晶的方法,所以从KCl溶液中得到KCl固体采用蒸发结晶的方法,故选择装置D;氯离子易溶于水,但难挥发,水易被蒸发,所以除去自来水中的Cl-等杂质采用蒸馏的方法,故选择装置A;
(2)碘易溶于有机溶剂而难溶于水,从碘水中分离出I2可以加入四氯化碳萃取、分液,选择装置B;
Ⅱ.(3)根据分析,除去粗盐中的可溶性杂质:Ca2+、Mg2+、SO42-时,先加水溶解,所以加入过量NaOH(去除镁离子);加入过量BaCl2(去除硫酸根离子);加入过量Na2CO3(去除钙离子的多余的钡离子):碳酸钠必须加在氯化钡之后,氢氧化钠和氯化钡可以颠倒加入的顺序,然后过滤,最后调节溶液的pH等于7后蒸发即可,所以其顺序是⑤③②①⑥④⑦或⑤②③①⑥④⑦;故答案为:d;
(4)实验步骤中加入过量的Na2CO3溶液的目的是除去溶液中的Ca2+和过量的Ba2+,发生反应的离子方程式有![]() 、
、![]() ;
;
(5)由海水到氯化钠晶体的实验过程中要用到蒸发的方法,为除去杂质,应过滤,主要装置是CD;故答案为:CD。


科目:高中化学 来源: 题型:
【题目】一种生产聚苯乙烯的流程如下,下列叙述不正确的是( )
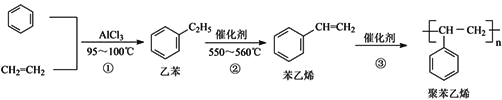
A. 乙烯可由石油裂解得到,苯可由煤的干熘得到,两者均发生了化学变化
B. 乙苯和氢气加成后的产物的一氯代物有5种
C. 鉴别乙苯与聚苯乙烯不可用Br2的四氯化碳溶液
D. 乙烯和聚苯乙烯均可以和H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们将有机物中连有四个不同原子(或原子团)的碳原子称为手性碳原子,如图所示烷烃X中含有一个手性碳原子(用*标记)。含有手性碳原子的物质通常具有光学活性。回答下列问题:

(1)烷烃X的名称是_____________;其一氯代物共有__________种(不考虑立体异构,下同)。
(2)具有光学活性且相对分子质量最小的烷烃的分子式是__________,其有__________种符合条件的结构。
(3)某芳香烃A可经过如下反应得到一种热塑性塑料SAN(两种单体1:1共聚产物)。

写出SAN的结构简式:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.铜跟硝酸银溶液反应:![]()
B.碳酸钙与盐酸反应:![]()
C.足量的CO2与澄清石灰水反应:![]()
D.Ba(OH)2与CuSO4溶液反应:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】六苯乙烷为无色晶体,其结构如图所示。下列有关说法中正确的是( )
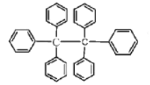
A. 它是一种苯的同系物,易溶于有机溶剂中
B. 它的分子式为C38H30,只含有非极性键
C. 核磁共振氢谱有3组峰
D. 它的分子中所有原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑,下列说法正确的是( )
MnCl2+2H2O+Cl2↑,下列说法正确的是( )
A.MnO2是还原剂
B.HCl 是氧化剂
C.若生成7.1gCl2,则转移0.1 mol电子
D.若生成7.1gCl2,被氧化的盐酸的物质的量是0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理应用和处理氮的化合物,在生产生活中有重要意义。
(1)尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料。
①CO(NH2)2(s)+H2O(1)2HN3(g)+CO2(g)ΔH=+133.6kJ/mol。关于该反应的下列说法正确的是____________(填序号)。
a.从反应开始到平衡时容器中混合气体的平均相对分子质量保持不变
b.在平衡体系中增加水的用量可使该反应的平衡常数增大
c.降低温度可使尿素的转化率增大
d.达到平衡后,缩小容器的体积,平衡向逆反应方向移动,达到平衡时NH3的浓度大于原平衡
②尿素在一定条件下可将氮的氧化物还原为氮气。
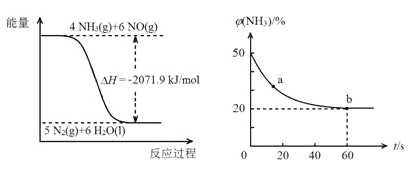
已知:
再结合①中的信息,则反应2CO(NH2)2(s)+6NO(g)5N2(g)+2CO2(g)+4H2O(1)的ΔH=______kJ/mol。
③密闭容器中以等物质的量的NH3和CO2为原料,在120℃、催化剂作用下应生成尿素:CO2(g)+2NH3(g)CO(NH2)2(s)+H2O(g),混合气体中NH3的物质的量百分含量随时间变化关系如图所示,氨气的平衡转化率为____________
(2)NO2会污染环境,可用Na2CO3溶液吸收NO2并生成CO2,已知9.2gNO2和Na2CO3溶液完全反应时转移电子0.1mol,恰好反应后,使溶液中的C元素全部以CO2形式逸出,所得溶液呈弱碱性,则溶液中离子浓度大小关系是c(Na+)>_________________________。
(3)用肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH的浓度来制备纳米Cu2O,装置如图所示:
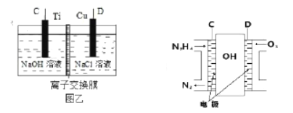
上述装置中阳极反应式为_________________________,该电解池中的离子交换膜为______________(填“阴”或“阳”)离子交换膜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在探究新制饱和氯水成份的实验中,下列根据实验现象得出的结论不正确的是( )
A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C.向淀粉碘化钾溶液中滴加少量氯水,溶液变蓝,说明氯水中含有ClO-
D.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com