
【题目】下列离子方程式书写正确的是( )
A.铜跟硝酸银溶液反应:![]()
B.碳酸钙与盐酸反应:![]()
C.足量的CO2与澄清石灰水反应:![]()
D.Ba(OH)2与CuSO4溶液反应:![]()
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的短周期主族元素,分布在三个不同周期。X、Y、Z、W为这些元素形成的化合物,X为二元化合物且为强电解质,W的水溶液呈碱性,物质的转化关系如图所示。下列说法中正确的是
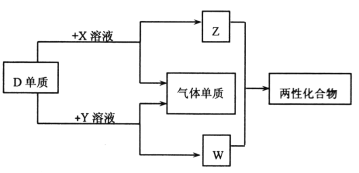
A. 对应的简单离子半径:C>D>B
B. D、E形成的化合物为含有极性共价键的共价化合物
C. 电解C、E形成的化合物水溶液,可生成C、E对应的单质
D. 由A、B、E形成的化合物都含有共价键,溶液都呈强酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】唐山市打造“山水园林城市”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:
SO2(g)+NH3·H2O(aq)![]() NH4HSO3(aq) ΔH1=a kJ·mol1;
NH4HSO3(aq) ΔH1=a kJ·mol1;
NH3·H2O(aq)+ NH4HSO3(aq)![]() (NH4)2SO3(ag)+H2O(l) ΔH 2=b kJ·mol1;
(NH4)2SO3(ag)+H2O(l) ΔH 2=b kJ·mol1;
2(NH4)2SO3(aq)+O2(g)![]() 2(NH4)2SO4(aq) ΔH 3=c kJ·mol1。
2(NH4)2SO4(aq) ΔH 3=c kJ·mol1。
则反应2SO2(g)+4NH3·H2O(aq)+O2(g) ![]() 2(NH4)2SO4(aq)+2H2O(l)的ΔH =____kJ·mol1。
2(NH4)2SO4(aq)+2H2O(l)的ΔH =____kJ·mol1。
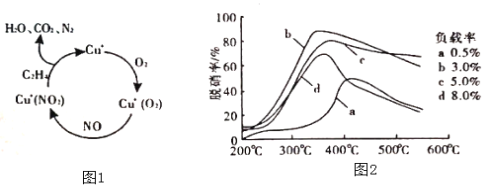
(2)以乙烯(C2H4)作为还原剂脱硝(NO),脱硝机理如图1,则总反应的化学方程式为_______;脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2,为达到最佳脱硝效果,应采用的条件是______。
(3)T1温度时在容积为2L的恒容密闭容器中发生反应:2NO(g)+O2(g)![]() 2NO2(g) △H<0。实验测得:υ正=υ(NO)消耗=2υ(O2)消耗=k正c2(NO)·c(O2),υ逆=(NO2) 消耗=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:
2NO2(g) △H<0。实验测得:υ正=υ(NO)消耗=2υ(O2)消耗=k正c2(NO)·c(O2),υ逆=(NO2) 消耗=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 1 | 0.6 | 0.4 | 0.2 | 0.2 | 0.2 |
n(O2)/mol | 0.6 | 0.4 | 0.3 | 0.2 | 0.2 | 0.2 |
①T1温度时k正/k逆=__________ L/mol。
②若将容器的温度改变为T2时其k正=k逆,则T2__________T1(填“>”、“<”或“=")。
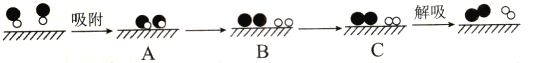
(4)已知:N2(g)+O2(g)![]() 2NO(g) △H=+181.5 kJ·mol-1,某科研小组尝试利用固体表面催化工艺进行NO的分解。若用
2NO(g) △H=+181.5 kJ·mol-1,某科研小组尝试利用固体表面催化工艺进行NO的分解。若用![]() 、
、![]() 、
、![]() 和
和![]() 分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是___(填字母序号)。
分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是___(填字母序号)。
(5)利用电解法处理高温空气中稀薄的NO(O2浓度约为NO浓度的10倍),装置示意图如下,固体电解质可传导O2-
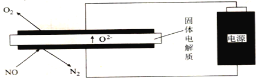
①阴极的电极反应式为______。
②消除一定量的NO所消耗的电量远远大于理论计算量,可能的原因是(不考虑物理因素)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验操作和现象所得出的结论不正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向NaHS溶液中滴入酚酞 | 溶液变红色 | HS-水解程度大于电离程度 |
B | 向浓度均为0.1mol/L的MgCl2、CuCl2混合溶液中逐滴加入氨水 | 出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
C | 向Na2CO3溶液中加入浓盐酸,将产生的气体通入硅酸钠溶液中 | 产生白色浑浊 | 酸性:盐酸>碳酸>硅酸 |
D | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液 | 前者溶液变蓝色,后者有黄色沉淀 | KI3溶液中存在I |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有600mL某种混合物溶液,只可能含有以下离子中的若干种![]()
![]() 、
、![]() 、
、![]() ,现将此溶液分成三等份,进行如下实验
,现将此溶液分成三等份,进行如下实验
①向第一份中加入AgNO3溶液,有沉淀产生;
②向第二份中加足量NaOH溶液并加热后,收集到气体0.04 mol;(![]() 条件为加热)
条件为加热)
③向第三份中加足量BaCl2溶液后,得干燥的沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。
根据上述实验,以下推测错误的是( )
A.K+一定存在
B.Ba2+、Mg2+一定不存
C.Cl- 一定存在
D.混合溶液中![]() 的浓度为0.1 mol/L
的浓度为0.1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下图1所示是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
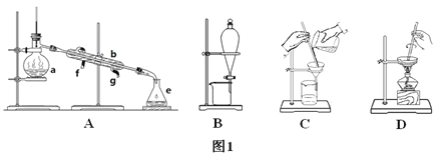
(1)从氯化钾溶液中得到氯化钾固体选择装置________(填代表装置图的字母,下同);除去自来水中的氯离子等杂质选择装置________。
(2)从碘水中分离出I2选择装置________,该分离方法的名称为________。
Ⅱ.海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如图2流程的实验:
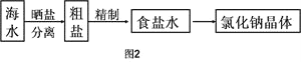
(3)粗盐中含![]() 等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有: ①加入过量的Na2CO3溶液②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④加入盐酸调节溶液至中性;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是(填写序号字母)_________________。
等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有: ①加入过量的Na2CO3溶液②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④加入盐酸调节溶液至中性;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是(填写序号字母)_________________。
A.⑤②③①④⑥⑦ B.⑤①②③⑥④⑦ C.⑤②①③④⑥⑦ D.⑤③②①⑥④⑦
(4)写出上述实验步骤中加入过量的Na2CO3溶液时发生反应的离子方程式:______________________,_______________________。
(5)由海水到氯化钠晶体的实验过程中要用到的主要装置是(从图1中给定的四种装置中选择)______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用浓度为0.01mol·L-1的HA溶液滴定20mL浓度为0.01mol·L-1的NaOH溶液,滴定曲线如图所示。下列说法错误的是( )
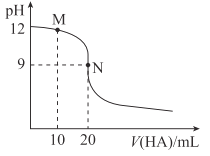
A. 应选用酚酞作指示剂
B. M点溶液中存在:c(Na+)>c(A-)
C. Ka(HA)≈2×10-8
D. N点溶液中存在:c(OH-)-c(H+)=c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气含有SO2和NOx,会污染大气。采用NaClO、Ca(C1O)2溶液作为吸收剂可同时对烟气进行税硫、脱硝,下列说法正确的是
①SO2(g)+2OH-(aq)![]() SO32-(aq)+H2O(l) ΔH1=a KJ/mol
SO32-(aq)+H2O(l) ΔH1=a KJ/mol
②ClO-(aq)+SO32-(aq)![]() SO42-(aq)+Cl-(aq) ΔH2=b KJ/mol
SO42-(aq)+Cl-(aq) ΔH2=b KJ/mol
③CaSO4(s)![]() Ca2+(aq)+ SO42- (aq) ΔH3=c KJ/mol
Ca2+(aq)+ SO42- (aq) ΔH3=c KJ/mol
④SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)![]() CaSO4(s)+H2O(l)+Cl-(aq)ΔH4=dKJ/mol
CaSO4(s)+H2O(l)+Cl-(aq)ΔH4=dKJ/mol
A. 随着吸收反应的进行,吸收剂溶液的pH逐渐减小
B. 反应①、②均为氧化还原反应
C. 反应Ca(OH)2(aq)+H2SO4(aq)=CaSO4(s)+2H2O(1)的ΔH=-ckJ/mol
D. d=a+b+c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活性ZnO在橡胶、塑料等工业中有重要应用,某工厂以含铅锌烟气(主要成分是ZnO、PbO,还有少量FeO、CuO)制备活性ZnO的工艺流程如下:

(1)下图为温度与Zn、Pb元素浸出率的关系图,“酸浸”时采用30℃而不是更高的温度的原因是:①减少盐酸挥发;②____。

(2)“氧化”的目的是除去酸浸液中的Fe2+,在pH约为5.1的溶液中,加入高锰酸钾溶液,生成MnO2和Fe(OH)3沉淀,该反应的离子方程式为____。
(3)①若“过滤I”所得的滤液浑浊,则处理的方法为____。
②“除杂”时,滤渣Ⅱ的主要成分是Cu、Pb,试剂X应为____。
(4)在“过滤Ⅱ”后的溶液中加入Na2CO3溶液,生成碱式碳酸锌[Zn2(OH)2CO3]等物质。
①该反应的化学方程式为____。
②检验碱式碳酸锌洗涤干净的操作为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com