
【题目】常温下,用 0.1000 mol·L-1NaOH溶液滴定 20.00mL某未知浓度的CH3COOH溶液,滴定曲线如图所示。已知在点③处恰好中和。下列说法错误的是
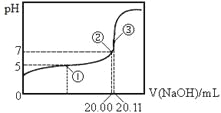
A.该温度下CH3COOH的电离平衡常数约为1.8 ×10-5
B.点①处溶液中c(CH3COO-)<c(CH3COOH)
C.点③处溶液中c(OH-)= c(CH3COOH)+c(H+)
D.滴定过程中不可能出现:c(CH3COOH) >c(CH3COO-)> c(OH-)> c(Na+)> c(H+)
【答案】B
【解析】
A、①点时,溶液为缓冲溶液,故可根据pka=pH+lg(c碱/c酸)计算,c(HAc)=![]() =0.1055mol/L,代入表达式可得到:pka=pH+lg(
=0.1055mol/L,代入表达式可得到:pka=pH+lg(![]() )="1.8" ×10-5,故A正确;
)="1.8" ×10-5,故A正确;
B、点①对应氢氧化钠的体积恰好是10mL,即乙酸和乙酸钠物质的量各占一半,但是由于乙酸的电离程度大于水解程度,故c(CH3COO-)<c(CH3COOH),错误;
C、③处恰好中和说明氢氧化钠与醋酸的物质的量相等,pH值大于7,是由于醋酸根离子水解生成OH-,水解部分很少,故根据物料守恒:c(Na+)=c(Ac-)+c(HAc),电荷守恒可得到:c(Na+)+c(H+)=c(Ac-)+c(OH-),整理可得到:c(OH-)= c(CH3COOH)+c(H+),故C正确;
D、滴定过程中,c(CH3COO-)> c(OH-)> c(Na+)> c(H+)都是阴离子大于阳离子,电荷不守恒,故D正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是()
A.黄绿色的氯水光照后颜色变浅
B.红棕色的二氧化氮加压后颜色先变深再变浅
C.合成氨工业使用催化剂提高氨的产量
D.工业上生产硫酸的过程中,使用过量的空气以提高二氧化硫的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭容器中进行反应:3SiCl4(g)+2N2(g)+6H2(g) ![]() Si3N4(s)+12HCl(g)能表示上述反应达到化学平衡状态的是
Si3N4(s)+12HCl(g)能表示上述反应达到化学平衡状态的是
A.v逆(N2)=3v正(H2)
B.v正(HCl)=4v正(SiCl4)
C.混合气体密度保持不变
D.c(N2) :c(H2) :c(HCl)=1:3:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一容积为5 L的密闭容器内,加入0.2 mol的CO和0.2 mol的H2O,在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),反应中CO2的浓度随时间变化情况如图:
CO2(g)+H2(g),反应中CO2的浓度随时间变化情况如图:

(1)根据图中数据,反应开始至达到平衡时,CO的化学反应速率为_______,反应达平衡时,c(H2)=______。
(2)判断该反应达到平衡的依据是______(填序号)。
①CO减少的速率和CO2减少的速率相等
②CO、H2O、CO2、H2的浓度都相等
③CO、H2O、CO2、H2的浓度都不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断裂1mol化学键所需的能量(kJ):N≡N键为942、N—N键为154、N—H键为391、H—O键为463。有关化学反应的能量变化如图所示。下列说法正确的是( )
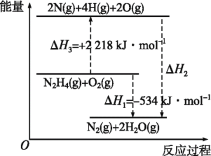
A.ΔH2=ΔH1+ΔH3
B.断裂1molO2(g)中的共价键需要吸收500kJ的能量
C.ΔH2>ΔH1
D.N2H4(g)+O2(g)=N2(g)+2H2O(l) ΔH=-534kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲乙丙丁戊是中学常见的无机物,他们的转化关系如图所示![]() 某些条件和部分产物已略去
某些条件和部分产物已略去![]() 下列说法错误的是
下列说法错误的是![]()
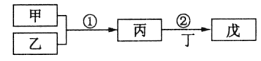
A.若戊为一种强碱且焰色反应为黄色,则反应![]() 可能都属于氧化还原反应
可能都属于氧化还原反应
B.常温下,若丙为无色气体,戊为红棕色气体,则甲、乙是铜和稀硝酸
C.若甲为硫磺燃烧产物,丁为水,则戊可用于干燥甲
D.若甲为浓盐酸,乙为![]() ,则戊可能使品红褪色
,则戊可能使品红褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】神舟十一号飞船搭乘CZ—2F火箭成功发射,在重达495吨的起飞重量中,95%的都是化学推进剂。
(1)CH3OH和液氧是常用的液体火箭推进剂。
①已知:
CO2(g)+3H2(g)CH3OH(g)+H2O(l) ΔH1
2H2(g)+O2(l)=2H2O(l) ΔH2
CH3OH(g)=CH3OH(l) ΔH3
2CH3OH(l)+3O2(l)=2CO2(g)+4H2O(l) ΔH4
则ΔH4=______(用ΔH1、ΔH2、ΔH3来表示)。
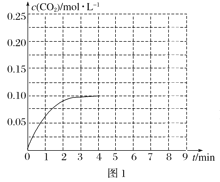
②某温度下,发生反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)。在体积为2L的密闭容器中加入1molCH3OH和1molH2O,第4min达到平衡,容器内c(CO2)随时间的变化情况如图1所示,求此反应在该温度下的平衡常数______(保留四位有效数字)。保持其他条件不变,在第5min时向体系中再充入0.2molCO2和0.4molH2,第8min重新达到平衡,此时c(H2)=c(CH3OH)。请在图1中画出5~9min的c(CO2)变化曲线示意图_______。
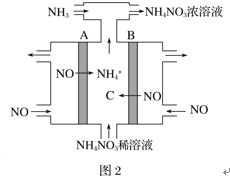
(2)NH4NO3也是一种重要的固体推进剂,可通过电解NO制备NH4NO3,其工作原理如图2所示,A电极的名称为______极,请写出在B电极上发生的电极反应式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行下列反应,M(g)+N(g) ![]() R(g)+2L, 此反应符合下图所示图象。R%为R在平衡混合物中的质量分数,则该反应
R(g)+2L, 此反应符合下图所示图象。R%为R在平衡混合物中的质量分数,则该反应

A. 正反应是吸热反应,L是气体
B. 正反应是放热反应,L是气体
C. 正反应是吸热反应,L是固体
D. 正反应是放热反应,L是固体或液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①H2(g)+![]() O2(g)=H2O(g) ΔH1=akJ·mol1
O2(g)=H2O(g) ΔH1=akJ·mol1
②2H2(g)+O2(g)=2H2O(g) ΔH2=bkJ·mol1
③H2(g)+![]() O2(g)=H2O(l) ΔH3=ckJ·mol1
O2(g)=H2O(l) ΔH3=ckJ·mol1
④2H2(g)+O2(g)=2H2O(l) ΔH4=d kJ·mol1
下列关系式中正确的是
A.a<c<0B.b>d>0C.2a=b<0D.2c=d>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com