
【题目】一定条件下,在密闭容器中进行反应:3SiCl4(g)+2N2(g)+6H2(g) ![]() Si3N4(s)+12HCl(g)能表示上述反应达到化学平衡状态的是
Si3N4(s)+12HCl(g)能表示上述反应达到化学平衡状态的是
A.v逆(N2)=3v正(H2)
B.v正(HCl)=4v正(SiCl4)
C.混合气体密度保持不变
D.c(N2) :c(H2) :c(HCl)=1:3:6
【答案】C
【解析】
A.由3SiCl4(g)+2N2(g)+6H2(g) ![]() Si3N4(s)+12HCl(g)可知,当3v逆(N2)=v正(H2)时,能表示反应达到化学平衡状态,故A不符合题意;
Si3N4(s)+12HCl(g)可知,当3v逆(N2)=v正(H2)时,能表示反应达到化学平衡状态,故A不符合题意;
B. 由3SiCl4(g)+2N2(g)+6H2(g) ![]() Si3N4(s)+12HCl(g)可知, 4v正(HCl)=v正(SiCl4) ,能表示反应达到化学平衡状态,故B 不符合题意;
Si3N4(s)+12HCl(g)可知, 4v正(HCl)=v正(SiCl4) ,能表示反应达到化学平衡状态,故B 不符合题意;
C. 由3SiCl4(g)+2N2(g)+6H2(g) ![]() Si3N4(s)+12HCl(g)可知,化学反应前后气体质量不等,容器的体积不变,所以混合气体密度保持不变,能表示反应达到化学平衡状态,故C 符合题意;
Si3N4(s)+12HCl(g)可知,化学反应前后气体质量不等,容器的体积不变,所以混合气体密度保持不变,能表示反应达到化学平衡状态,故C 符合题意;
D. 由3SiCl4(g)+2N2(g)+6H2(g) ![]() Si3N4(s)+12HCl(g)可知,浓度的变化量之比等于化学反应计量数之比,即c(N2) :c(H2) :c(HCl)=1:3:6,不能说明反应达到平衡状态,故D不符合题意;
Si3N4(s)+12HCl(g)可知,浓度的变化量之比等于化学反应计量数之比,即c(N2) :c(H2) :c(HCl)=1:3:6,不能说明反应达到平衡状态,故D不符合题意;
答案选C。


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值.下列说法正确的是( )
A. 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
B. 室温下,1 L pH=13的NaOH溶液中,由水电离的OH﹣离子数目为0.1NA
C. 氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA
D. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磺酰氯(SO2C12)是有机合成领域常用的氯化剂、磺化剂、氯磺化剂,熔点-54.1℃,沸点69.1℃,在潮湿空气中会产生酸雾,高温下容易分解。某化学小组用下图所示装置制取磺酰氯,反应原理是:SO2(g)+C12(g)=SO2C12 (1)△H=-97.3kJ/mol,请回答相关问题。

(1)仪器组装好以后首先要进行的操作是____。
(2)装置E的仪器名称是___,所装药品是____。
(3)若缺少装置B,三颈烧瓶中会发生的主要副反应化学方程式是____(任写一个)。装置B更换为某装置后可起到同样的作用,该装置可以是____。
(4)通过气体流量计测得通入Cl2的体积折合成标准状况为3.36L(SO2足量),最终得到的SO2C12质量为8.1g,则产率___。下列措施能提高SO2C12产率的是___。(填选项序号)
a.加快通入氯气的速率
b.三颈烧瓶温度过高时适当冷却
c.先打开分液漏斗活塞并通入氯气再通入冷凝水
(5)某同学在实验过程中不小心将SO2C12与H2SO4混合在一起,分离该混合物的方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。请完成下列填空:
实验编号 | 待测盐酸的体积(mL) | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) |
1 | 20.00 | 0.10 | 24.18 |
2 | 20.00 | 0.10 | 23.06 |
3 | 20.00 | 0.10 | 22.96 |
(1)根据上述数据,可计算出该盐酸的浓度约为_______________(保留四位有效数字)。
(2)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______。
A.用酸式滴定管取20.00 mL待测盐酸,使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体时,有小部分NaOH潮解
D.滴定终点读数时俯视
E.碱式滴定管尖嘴部分有气泡,滴定后消失
(3)氧化还原滴定实验同中和滴定类似,指的是用已知浓度的氧化剂(还原剂)溶液滴定未知浓度的还原剂(氧化剂)溶液。现有0.001 mol·L-1KMnO4酸性溶液和未知浓度的无色H2C2O4溶液。反应离子方程式是_________________________________,滴定达到终点的标志是___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列哪种说法可以证明反应N2+3H2![]() 2NH3达到平衡状态
2NH3达到平衡状态
A.1个N≡N键形成的同时,有3个H—H键形成
B.1个N≡N键断裂的同时,有3个H—H键断裂
C.1个N≡N键断裂的同时,有6个N—H键断裂
D.1个N≡N键断裂的同时,有6个N—H键形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3,还含有少量FeS2)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下,下列叙述不正确的是

A. 加入CaO可以减少SO2的排放同时生成建筑材料CaSO4
B. 向滤液中通入过量CO2、过滤、洗涤、灼烧沉淀可制得Al2O3
C. 隔绝空气焙烧时理论上反应消耗的n(FeS2)∶n(Fe2O3)=1∶5
D. 烧渣分离可以选择用磁铁将烧渣中的Fe3O4分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,研究氮氧化物等大气污染物对建设美丽家乡,打造宜居环境具有重要意义。NO在空气中存在如下反应:2NO(g)+ O2(g)![]() 2NO2(g)△H上述反应分两步完成,如下左图所示。
2NO2(g)△H上述反应分两步完成,如下左图所示。
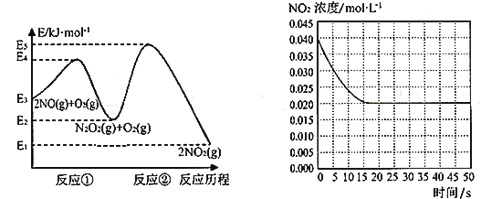
(1)写出反应①的热化学方程式(△H用含物理量E的等式表示):________。
(2)反应①和反应②中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g)![]() 2NO2(g)反应速率的是____(填“反应①”或“反应②”);对该反应体系升高温度,发现总反应速率变慢,其原因可能是____(反应未使用催化剂)。
2NO2(g)反应速率的是____(填“反应①”或“反应②”);对该反应体系升高温度,发现总反应速率变慢,其原因可能是____(反应未使用催化剂)。
(3)某温度下一密闭容器中充入一定量的NO2,测得NO2浓度随时间变化的曲线如上图所示。前5秒内O2的平均生成速率为_______;该温度下反应2NO+O2![]() 2NO2的化学平衡常数K为_____。
2NO2的化学平衡常数K为_____。
(4)对于(3)中的反应体系达平衡后(压强为P1),若升高温度,再次达平衡后,混合气体的平均相对分子质量_____(填“增大”、“减小”或“不变”);若在恒温恒容条件下,向其中充入一定量O2,再次达平衡后,测得压强为P2,c(O2)=0.09mol·L-1,则P1︰P2=___________。
(5)水能部分吸收NO和NO2混合气体得到HNO2溶液。若向20.00mL0.10mol·L-1HNO2溶液中逐滴加入0.10mol·L-1NaOH溶液,所得pH曲线如图所示,则A点对应的溶液c(Na+)/c(HNO2)=____。
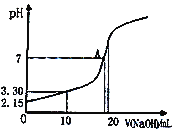
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)和铜(Cu)在生产生活中有广泛的应用。硒可以用作光敏材料、电解锰行业的催化剂,也是动物体必需的营养元素和对植物有益的营养元素等。氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下所示:
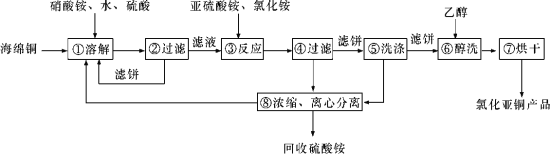
请回答下列问题:
(1)若步骤①中得到的氧化产物只有一种,则它的化学式是____________。
(2)写出步骤③中主要反应的离子方程式:_________。
(3)步骤⑤包括用pH=2的溶液酸洗、水洗两步操作,酸洗采用的酸是_______(写酸的名称)。
(4)上述工艺中,步骤⑥和⑦的作用是__________。
(5)Se为ⅥA族元素,用乙二胺四乙酸铜阴离子水溶液和硒代硫酸钠(Na2SeSO3)溶液反应可获得纳米硒化铜,硒代硫酸钠还可用于Se的精制,写出硒代硫酸钠(Na2SeSO3)与H2SO4溶液反应得到精硒的化学方程式:______________。
(6)氯化亚铜产率与温度、溶液pH关系如下图所示。据图分析,流程化生产氯化亚铜的过程中,温度过低影响CuCl产率的原因是_________;温度过高、pH过大也会影响CuCl产率的原因是____________。
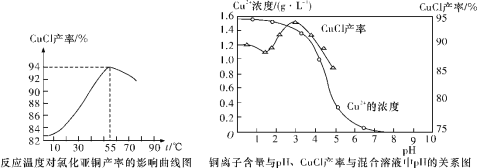
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列提供了有关物质的熔点,根据表中的数据,下列判断错误的是

A. AlF3晶体是离子晶体,AlCl3晶体是分子晶体
B. AlF3晶体的晶格能小于NaCl晶体的晶格能
C. 同族元素的氧化物可以形成不同类型的晶体
D. 不同族元素的氯化物可以形成相同类型的晶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com