
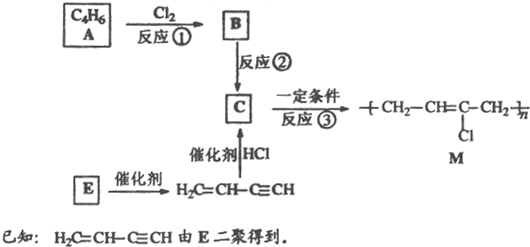

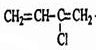 ����Ӧ��Ϊ�Ӿ۷�Ӧ���ɸ߷��ӣ����C�Ľṹ��֪����A�ķ���ʽ��֪��AΪ��״��Ӧ����2��C=C˫������AΪH2C=CH-CH=CH2��BΪH2C=CH-CH=CH2����������1��2-�ӳɲ��BΪ
����Ӧ��Ϊ�Ӿ۷�Ӧ���ɸ߷��ӣ����C�Ľṹ��֪����A�ķ���ʽ��֪��AΪ��״��Ӧ����2��C=C˫������AΪH2C=CH-CH=CH2��BΪH2C=CH-CH=CH2����������1��2-�ӳɲ��BΪ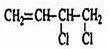 ���ڼ�Ĵ���Һ�з�����ȥ��Ӧ����C������������Ϣ��H2C=CH-C��CH��E���۵õ�����EΪHC��CH�����ۻ�״����Ϊ�����ľ۵õ��Ļ�״����Ϊ������ϩ�������뻷����ϩ������ˮ����������ȡ��ʹ��ˮ��ɫ��������ϩ�����巢���ӳɷ�Ӧʹ��ˮ��ɫ�������Ը��������Һ��������ʹ���Ը��������Һ��ɫ��������ϩ��ʹ���Ը��������Һ��ɫ�����ݴ˽��
���ڼ�Ĵ���Һ�з�����ȥ��Ӧ����C������������Ϣ��H2C=CH-C��CH��E���۵õ�����EΪHC��CH�����ۻ�״����Ϊ�����ľ۵õ��Ļ�״����Ϊ������ϩ�������뻷����ϩ������ˮ����������ȡ��ʹ��ˮ��ɫ��������ϩ�����巢���ӳɷ�Ӧʹ��ˮ��ɫ�������Ը��������Һ��������ʹ���Ը��������Һ��ɫ��������ϩ��ʹ���Ը��������Һ��ɫ�����ݴ˽��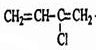 ����Ӧ��Ϊ�Ӿ۷�Ӧ���ɸ߷��ӣ�����C�Ľṹ��ʽ��A�ķ���ʽ��֪AΪ1��3-����ϩ��
����Ӧ��Ϊ�Ӿ۷�Ӧ���ɸ߷��ӣ�����C�Ľṹ��ʽ��A�ķ���ʽ��֪AΪ1��3-����ϩ��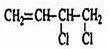 �ڼ�Ĵ���Һ�з�����ȥ��Ӧ����
�ڼ�Ĵ���Һ�з�����ȥ��Ӧ����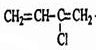 ����Ӧ����ʽΪ��
����Ӧ����ʽΪ�� ��
�� ��
�� ���ľ۵õ��Ļ�״����Ϊ
���ľ۵õ��Ļ�״����Ϊ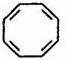 ����������ȡ��ʹ��ˮ��ɫ��������ϩ�����巢���ӳɷ�Ӧʹ��ˮ��ɫ��������ʹ���Ը��������Һ��ɫ��������ϩ��ʹ���Ը��������Һ��ɫ�����ʼ����뻷����ϩ������ˮ�����Ը��������Һ��
����������ȡ��ʹ��ˮ��ɫ��������ϩ�����巢���ӳɷ�Ӧʹ��ˮ��ɫ��������ʹ���Ը��������Һ��ɫ��������ϩ��ʹ���Ը��������Һ��ɫ�����ʼ����뻷����ϩ������ˮ�����Ը��������Һ�� ��
�� ����ˮ�����Ը��������Һ��
����ˮ�����Ը��������Һ��| �� |
| H2O |
| ���� |
| �� |
| H2O |
| ���� |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
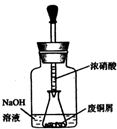 ��ʽ̼��ͭ Cu2��OH��2CO3��һ����;�㷺�Ļ���ԭ�ϣ�ʵ�����Է�ͭмΪԭ����ȡ��ʽ̼��ͭ�IJ������£�
��ʽ̼��ͭ Cu2��OH��2CO3��һ����;�㷺�Ļ���ԭ�ϣ�ʵ�����Է�ͭмΪԭ����ȡ��ʽ̼��ͭ�IJ������£��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��FeI2��FeBr2�Ļ����Һ��ͨ��������������Һ��ijЩ���ӵ����ʵ����仯��ͼ��ʾ����֪��2Fe2++Br2�T2Fe3++2Br-��2Fe3++2I-�T2Fe2++I2�����߶�BC��ʾ
��FeI2��FeBr2�Ļ����Һ��ͨ��������������Һ��ijЩ���ӵ����ʵ����仯��ͼ��ʾ����֪��2Fe2++Br2�T2Fe3++2Br-��2Fe3++2I-�T2Fe2++I2�����߶�BC��ʾ�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 180�� |
| ���� |
| ClO2 |
| ��Ӧ�� |
| Na2SO3ˮ��Һ |
| ��Ӧ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Ca��OH��2[CaCO3] |
| B��Fe��OH��3[Fe2O3] |
| C��KI[I2] |
| D��NaOH[Na2CO3] |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com