
【题目】已知25℃、101kPa时,一些物质的燃烧热为,回答下列问题:
化学式 | CO(g) | H2(g) | CH3OH(l) | CH4(g) |
△H/(kJ·mol-l) | -283.0 | -285.8 | -726.5 | -890.3 |
(1)写出该条件下CH3OH(l)完全燃烧的热化学方程式:_____________________________。
(2)根据盖斯定律完成下列反应的热化学方程式:CO(g)+2H2(g)![]() CH3OH(l)△H=__________。
CH3OH(l)△H=__________。
(3)工业上利用水煤气合成甲醇的主要反应可表示为![]() CO(g)+H2(g)
CO(g)+H2(g)![]()
![]() CH3OH(g)△H=-45.4kJ·mol-1。向容积为1L的密闭容器中加入0.10molH2和0.05molCO,在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出热量3.632kJ。
CH3OH(g)△H=-45.4kJ·mol-1。向容积为1L的密闭容器中加入0.10molH2和0.05molCO,在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出热量3.632kJ。
①相同温度条件下,上述反应的化学平衡常数K=___________。
②若容器容积不变,下列措施可增加CH3OH产率的是___________ (填标号)。
a.升高温度
b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大
d.再充入0.10molH2和0.05molCO
e.加入催化剂
③反应达到平衡后,保持其他条件不变,若只把容器的体积缩小一半,平衡将___________(填“逆向”“正向”或“不”)移动,化学平衡常数K___________(填“增大”“减小”或“不变”)。
④温度、容积相同的甲、乙两个密闭容器,若甲中加入1molCO和2molH2,乙中加入lmolCH3OH(g),反应达到平衡时甲放出的热量为Q1kJ,乙吸收的热量为Q2kJ,甲中CO的转化率为a1,乙中CH3OH的转化率为a2,则Q1+Q2=___________,a1+a2=___________。
【答案】 CH3OH(l)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=-726.5kJ·mol-l -128.1kJ·mol-1 100 bd 正向 不变 90.8 1
O2(g)=CO2(g)+2H2O(l)△H=-726.5kJ·mol-l -128.1kJ·mol-1 100 bd 正向 不变 90.8 1
【解析】试题分析:本题考查热化学方程式的书写,盖斯定律的应用,化学平衡常数的计算和影响化学平衡常数的因素,外界条件对化学平衡的影响,等效平衡的应用。
(1)根据燃烧热的概念,CH3OH(l)完全燃烧生成CO2(g)和H2O(l),CH3OH(l)完全燃烧的热化学方程式为CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l)ΔH=-726.5kJ/mol。
O2(g)=CO2(g)+2H2O(l)ΔH=-726.5kJ/mol。
(2)根据燃烧热可写出热化学方程式,
CO(g)+![]() O2(g)=CO2(g)ΔH=-283.0kJ/mol(①式)
O2(g)=CO2(g)ΔH=-283.0kJ/mol(①式)
H2(g)+![]() O2(g)=H2O(l)ΔH=-285.8kJ/mol(②式)
O2(g)=H2O(l)ΔH=-285.8kJ/mol(②式)
CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l)ΔH=-726.5kJ/mol(③式)
O2(g)=CO2(g)+2H2O(l)ΔH=-726.5kJ/mol(③式)
应用盖斯定律,①式+②式![]() 2-③式得CO(g)+2H2(g)
2-③式得CO(g)+2H2(g)![]() CH3OH(l)ΔH=(-283.0kJ/mol)+(-285.8kJ/mol)
CH3OH(l)ΔH=(-283.0kJ/mol)+(-285.8kJ/mol)![]() 2-(-726.5kJ/mol)=-128.1kJ/mol。
2-(-726.5kJ/mol)=-128.1kJ/mol。
(3)①由方程式知消耗1molH2放出45.4kJ的热量,放出3.632kJ热量消耗H2物质的量为3.632kJ![]() 45.4kJ/mol=0.08mol,用三段式
45.4kJ/mol=0.08mol,用三段式
![]() CO(g)+H2(g)
CO(g)+H2(g)![]()
![]() CH3OH(g)
CH3OH(g)
c(起始)(mol/L)0.05 0.10 0
c(转化)(mol/L)0.04 0.08 0.04
c(平衡)(mol/L)0.01 0.02 0.04
反应的平衡常数K=![]() /(
/(![]() 0.02)=100。
0.02)=100。
②a项,升高温度,平衡向逆反应方向移动,CH3
③该反应的正反应为气体分子数减小的反应,把容器的体积缩小一半,即增大压强,平衡将正向移动。化学平衡常数只与温度有关,温度不变,化学平衡常数K不变。
④甲从正反应开始建立平衡,乙从逆反应开始建立平衡;恒温恒容容器中,将乙容器中起始1molCH3OH(g)采用极限法“一边倒”换算后,CO、H2、CH3OH依次为1mol、2mol、0,与甲容器中起始物质的量对应相等,则甲、乙达到平衡时为完全全等的等效平衡,根据等效平衡的规律知,Q1+Q2=90.8,a1+a2=1。


科目:高中化学 来源: 题型:
【题目】金属(M)–空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH) n。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是

A. 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B. 比较Mg、Al、Zn三种金属–空气电池,Al–空气电池的理论比能量最高
C. M–空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne–=4M(OH)n
D. 在Mg–空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟及其化合物用途非常广泛。回答下列问题:
(1)基态氟原子的价电子排布式为_________________。
(2)C2F4可用于合成聚四氟乙烯,HBF4可用于蚀刻玻璃,NO2F可用作火箭推进剂中的氧化剂,NaAlF6可用作电冶铝的助培剂。
①C2F4分子中所含共价键的类型有_____,C2F4分子中碳原子的杂化轨道类型是____,聚四氟乙烯是一种准晶体,证明它不是晶体可用的实验方法是_______________。
②HF与BF3化合可得到HBF4,从价键形成角度分析HF与BF3能化合的原因_______________。
③与NO2F分子互为等电子的非极性分子有__________(写一个符合要求的化学式即可)。
(3)CaF2的晶体结构如图所示。
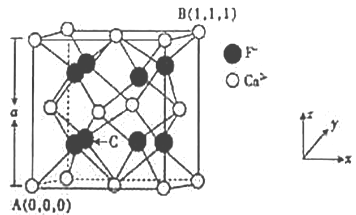
①CaF2晶胞中,Ca2+的配位数为_____;F-的配位数为_____。
②原子坐标参数可表示晶胞内部各原子的相对位置,已知A、B两点的原子坐标参数如图所示,则C点的原子坐标参数为______________。
③晶胞参数可描述晶胞的大小和形状,CaF2晶胞的晶胞参数。A=546.2pm,则其密度为_____(列出计算式即可)g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,H3AsO4溶液中各含砷粒子分布分数(平衡时该粒子的浓度与各含砷粒子浓度之和的比)与pH的关系如右图所示。下列说法正确的是
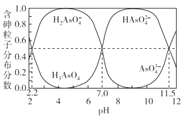
A. H3AsO4的第一步电离常数Ka1>0.01
B. pH=7.0时.溶液中c(AsO43-)=c(H3AsO4)=0
C. 0.1mol·L-1H3AsO4溶液的pH<2
D. pH=12时,c(H+)=3c(AsO43-)+2c(HAsO42-)+c(H2AsO4-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa,25℃时,H2A的pKa1=1.85,pKa2=7.19。常温下,用0.1mol·L—1NaOH溶液滴定20mL0.l mol·L—1H2A溶液的滴定曲线如右图所示(曲线上的数字为pH)。下列说法正确的是

A. a点所得溶液中c(H2A)+c(A2—)+c(HA—)=0.1 mol·L—1
B. b点所得溶液中:c(H2A)+2c(H+)=c(A2—)+2c(OH—)
C. 对应溶液的电导率:a<b<c<d
D. 对应溶液水的电离程度:a>b>c>d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组对一种废旧合金(含有Cu、Fe、Si等元素)进行分离、回收再利用,所设计工艺流程如下。
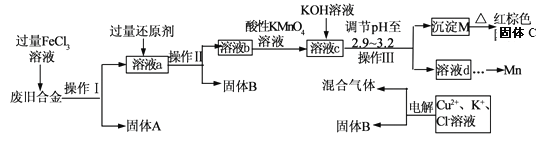
已知:298K时,Ksp[Fe(OH)3]=4.0×10—38,Ksp[Cu(OH)2]=2.2×10一20,
Ksp[Mn(OH)2]=1.9×10—13
回答下列问题:
(1)操作I、Ⅱ、Ⅲ为________,固体B为_________ (填化学式)。
(2)加人过量FeCl3溶液过程中与较不活泼的金属反应的离子方程式__________________。
(3)调节pH至2.9~3.2的目的是分离_________ (填离子符号)
(4)①向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为_________________。
②若用 a mol/LKMnO4溶液处理溶液b,当恰好反应时消耗KMnO4溶液V mL,所得红棕色固体C的物质的量为_________(用含a、v的代数式表示)
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,最后生成的沉淀为_________ (填化学式)。
(6)用惰性电极电解时阳极产生标准状况下的气体6.72L,阴极得到的电子数为0.8NA,则生成氧气的物质的量为________ mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,在20.0mL0.10mol·L-1氯水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。己知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是

A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0mL
C. M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N点处的溶液中pH<12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,0.100 0 mol·L-1Na2CO3溶液25 mL用0.1000 mol·L-1盐酸滴定,滴定曲线如图。对滴定过程中所得溶液中相关离子浓度间的关系,下列说法正确的是( )

A. a点:c(CO32-)>c(HCO3-)>c(OH-)
B. b点:5c(Cl-)>4c(HCO3-)+4c(CO32-)
C. c点:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
D. d点:c(H+)>2c(CO32-)+c(HCO3-)+c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com