
【题目】根据如图所示的各物质能量变化关系,判断下列热化学方程式正确的是

A. C(s,金刚石)+O2(g)===CO2(g) ΔH1=a kJ/mol(a<0)
B. C(s,石墨)+O2(g)===CO2(g) ΔH2=b kJ/mol(b>0)
C. C+O2===CO2(g) ΔH3=c kJ/mol(c<0)
D. C(s,金刚石)===C(s,石墨) ΔH4=d kJ/mol(d>0)
科目:高中化学 来源: 题型:
【题目】短周期M、N两种元素对应的简单离子分别为mMa+、n Nb-,若离子的核外电子排布相同,则下列关系不正确的是( )
A. 原子半径:M < NB. 离子半径:M < N
C. 原子序数:M > ND. 主族序数:M < N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对利用甲烷消除NO2污染进行研究,CH4+2NO2![]() N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
组别 | 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | 0.15 |
下列说法正确的是( )
A. 由实验数据可知实验控制的温度T2>T1
B. 组别①中,0~20min内,NO2的降解速率为0.0125mol·L-1·min-1
C. 40min时,表格中T2对应的数据为0.18
D. 0~10min内,CH4的降解速率①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用下列装置进行乙醇催化氧化的实验。
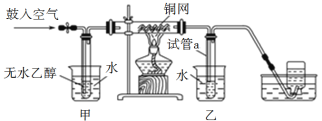
(1)实验过程中铜网出现红色和黑色交替的现象,实际上是发生了两个化学反应,请写出它们的化学方程式_______、______。
(2)甲和乙两个水浴作用不相同。甲的作用是________________,乙的作用是________________。
(3)反应进行一段时间后,试管a中能收集到不同的物质,它们是_______;集气瓶中收集到的气体的主要成分是_______________。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还有________________。要除去该物质,可先在混合液中加入________(填字母),然后再通过蒸馏即可除去。
a 氯化钠溶液 b 苯 c 碳酸氢钠溶液 d 四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行如下反应:X2(g)+Y2(g) ![]() 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时各物质的浓度有可能是( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时各物质的浓度有可能是( )
A.X2为0.2 mol·L-1
B.Y2为0.45 mol·L-1
C.Z为0.35 mol·L-1
D.Z为0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g) + I2(g)![]() 2HI(g) ΔH=-a kJ·mol-1
2HI(g) ΔH=-a kJ·mol-1
已知: (a、b、c均大于零)
(a、b、c均大于零)
下列说法不正确的是( )
A. 反应物的总能量高于生成物的总能量
B. 断开1 mol H-H键和1 mol I-I键所需能量大于断开2 mol H-I键所需能量
C. 断开2 mol H-I键所需能量约为(c+b+a) kJ
D. 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R是原子序数依次增大的前四周期元素,这五种元素的相关信息如下:
元素 | 相关信息 |
X | 其中一种核素在考古时常用来鉴定一些文物的年代 |
Y | 原子核外电子有7种不同的运动状态 |
Z | 地壳中含量最高的元素 |
W | 价电子排布式为(n+1)sn(n+1)pn+2 |
R | 基态原子最外能层只有一个电子,其他能层均已充满电子 |
(1)基态R原子的电子排布式为______________________________________。
(2)Y2分子中σ键和π键的数目比为________________。
(3)X、Y、Z三种元素的第一电离能由小到大的顺序为____________(用元素符号表示),元素Y的简单气态氢化物的沸点比元素X的简单气态氢化物沸点高的主要原因是_____________。
(4)元素Z、W组成的微粒WZ42-的空间构型是______,其中W原子的杂化轨道类型为________。
(5)已知Z、R能形成一种化合物,其晶胞结构如图所示,该化合物的化学式为________;若相邻的Z原子和R原子间的距离为a cm,设阿伏加德常数的值为NA,则该晶体的密度为__________g·cm-3(用含a、NA的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活息息相关,以下做法不正确的是( )
A. 集中处理废旧电池,以防止重金属污染
B. 食用含铁丰富的食物,可预防缺铁性贫血
C. 使用加碘食盐,可预防因缺碘引起的甲状腺肿大
D. 大量使用食品添加剂,可使食品营养更丰富
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产水煤气的反应为:C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+131.4kJ·mol-1下列判断正确的是
CO(g)+H2(g) ΔH=+131.4kJ·mol-1下列判断正确的是
A. 反应物能量总和大于生成物能量总和
B. CO(g)+H2(g)![]() C(s)+H2O(g)ΔH=+131.4kJ·mol-1
C(s)+H2O(g)ΔH=+131.4kJ·mol-1
C. 水煤气反应中,生成1 mol H2(g)吸收131.4 kJ热量
D. 水煤气反应中生成1体积CO(g)吸收131.4 kJ热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com