
����Ŀ��Cr��Co��Al�ĺϽ�����ػ�������;�dz��㷺��
(1) Cr3+��̬��������Ų�ʽΪ___________��
(2)1951��Tsao���籨����LiAlH4��ԭ�棬�練Ӧ�� ��
��
��LiAlH4������Ԫ�صĵ縺�ԴӴ�С��˳��Ϊ___________��
��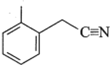 ������̼ԭ�ӵĹ���ӻ�����Ϊ__________��1mol�÷����к��Ҽ������ʵ���Ϊ__________��
������̼ԭ�ӵĹ���ӻ�����Ϊ__________��1mol�÷����к��Ҽ������ʵ���Ϊ__________��
(3) [Co(15-��-5)(H2O)2]2+��һ����λ����(��15-��-5����ָ���ѵĻ���ԭ������Ϊ15������Oԭ����Ϊ5)�����ڸ���λ���ӽṹʾ��ͼ(ͼ-1)�е���Ӧλ�ò�������λ��____________��
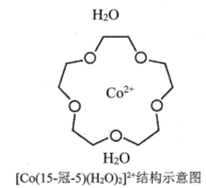 ͼ1
ͼ1
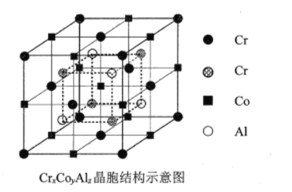 ͼ2
ͼ2
(4)ȫ��˹�պϽ�CrxCoyAlz�ľ����ṹ����ͼ-2��ʾ�����仯ѧʽΪ___________
���𰸡�[Ar]3d3 ��1s22s22p63s23p63d3 H��Al��Li sp��sp2��sp3 19mol  Cr2CoAl
Cr2CoAl
��������
(1)Cr��24��Ԫ�أ����̬ԭ�ӵĺ�������Ų�Ϊ[Ar]3d54s1����1s22s22p63s23p63d54s1��ʧȥ3�����ӣ��γ�Cr3������Cr3+��̬��������Ų�ʽΪ[Ar]3d3��1s22s22p63s23p63d3��
(2)��Ԫ�صĽ�����Խǿ���縺��ԽС���ڳ����£�Li����ˮ��Ӧ��Al����ˮ��Ӧ��˵��Li�Ľ�����ǿ��Al������縺��С��Al��Al��Li�������ᷴӦ�û���H2��˵��H�ĵ縺�������LiAlH4������Ԫ�صĵ縺�ԴӴ�С��˳��ΪH��Al��Li��
���л���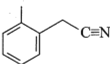 �к��б��͵�̼ԭ�ӣ�Ҳ���γ�̼̼˫����̼ԭ�ӣ������������ɵ�˫������Ľṹ����Ҳ���γ�̼̼������̼ԭ�ӣ�̼ԭ�ӵ��ӻ����ͷֱ��ȡsp��sp2��sp3�����еĵ�����̼̼������̼�ⵥ������Ϊ������̼̼˫���������������ɵ�˫������Ľṹ����̼����������1����Ϊ��������1mol�÷����к����������ʵ���Ϊ19mol��
�к��б��͵�̼ԭ�ӣ�Ҳ���γ�̼̼˫����̼ԭ�ӣ������������ɵ�˫������Ľṹ����Ҳ���γ�̼̼������̼ԭ�ӣ�̼ԭ�ӵ��ӻ����ͷֱ��ȡsp��sp2��sp3�����еĵ�����̼̼������̼�ⵥ������Ϊ������̼̼˫���������������ɵ�˫������Ľṹ����̼����������1����Ϊ��������1mol�÷����к����������ʵ���Ϊ19mol��
(3)���Ѻ�H2O�е�Oԭ�Ӿ����й¶Ե��ӣ�����Co2���γ���λ������λ����ͼ��ʾ��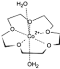 ��
��
(4)���ݾ����ṹ��λ�ھ����ڲ���Cr��4������Ϊ�˾������У�λ�ڶ����Cr��8����Ϊ8�����������ã�λ�����ĵ�Cr��6����Ϊ2�����������У������ڴ˾�����Cr��![]() ����λ�ھ����������ϵ�Co����12����Ϊÿ��CoΪ4�����������У������ĵ�Co��1����Ϊ�˾������У������ڴ˾�����Co��
����λ�ھ����������ϵ�Co����12����Ϊÿ��CoΪ4�����������У������ĵ�Co��1����Ϊ�˾������У������ڴ˾�����Co��![]() ����Alλ�ھ������ڲ�����Ϊ�˾������У�����4��������Cr��Co��Al�ĸ�����Ϊ8��4��4=2��1��1����Ͻ�Ļ�ѧʽΪCr2CoAl��
����Alλ�ھ������ڲ�����Ϊ�˾������У�����4��������Cr��Co��Al�ĸ�����Ϊ8��4��4=2��1��1����Ͻ�Ļ�ѧʽΪCr2CoAl��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ҷ�ȩ(OHC��CHO)��һ����Ҫ�ľ�ϸ������Ʒ��ijС��������ȩҺ�������������Ʊ��Ҷ�ȩ���ⶨ�Ҷ�ȩ���ȣ�װ����ͼ��ʾ��
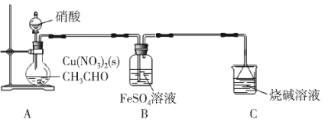
��֪����NO��FeSO4��FeSO4��NO(��ɫ)��
�ڼ����л���IJ������������ʾ��
��ȩ | �Ҷ�ȩ | �Ҷ��� | ���� | |
�е�/�� | 20.8 | 50.5 | 109 | 117.9 |
�ܽ��� | ��ˮ���л��ܼ����� | ����ˮ���Ҵ��� | ����ˮ���л��ܼ� | ��ˮ���Ҵ����� |
�ܶ�/gcm-3 | 0.78 | 1.27 | 1.90 | 1.05 |
��Է������� | 44 | 58 | 90 | 60 |
ʵ�鲽�裺
��ȡ20 mL��ȩװ����ƿ������2 g Cu(NO3)2��ĩ������������ƿ�л����μ�2 mol��L��1��������ȩ��ȫ��ӦΪֹ��
���ᴿ��Ʒ�����յõ�10.0 mL��Ʒ��
��ش��������⣺
(1)ʢװ���������������___________��
(2)ʵ���У��۲쵽װ��B����Һ��Ϊ��ɫ���Ʊ��Ҷ�ȩ�Ļ�ѧ����ʽΪ________________��
(3)����ƿ�еμ�����Ҫ������������Ŀ����___________���ж���ƿ���Ʊ��Ҷ�ȩ�ķ�Ӧ����ɵı�־��___________��
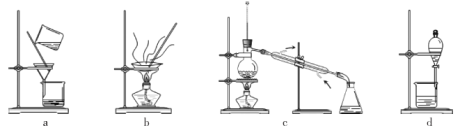
(4)�����ᴿ��Ʒ����ѡ������װ��___________(����ĸ)��
(5)��������ʵ�����ݣ���ʵ�����Ҷ�ȩ�IJ���ԼΪ___________(����ĸ)��
a.56.5% b.61.8% c.67.9% d.72.6%
(6)ʵ���ҿ�������KMnO4��Һ�ⶨ�Ҷ�ȩ�Ĵ��ȣ�������Ӧ�����ӷ���ʽΪ��18H����6MnO4����5C2H2O2��10CO2����6Mn2����14H2O��ʵ�鲽�����£�ȡV mL��Ʒ��������ˮϡ����250 mL����ȡ25.00 mLϡ�ͺ����Һ����ƿ���μ�5.00 mLϡ���ᣬ��c mol��L��1 KMnO4��Һ������ƽ��ʵ������KMnO4��Һ������£�
ʵ�� | �� | �� | �� |
V[KmnO4(aq)]/mL | 20.05 | 22.40 | 19.95 |
�ζ��յ�ı�־��___________���ò�Ʒ����Ϊ___________g��mL��1(�ú�V��c�Ĵ���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH4Cl��ʵ���ҳ����Լ����������˵����ȷ����
A.��Ӧ2NH4Cl(s)+Ba(OH)2(s)=BaCl2(s)+2NH3(g)+2H2O(s)����H>0����S<0
B.0.1mol��L��1NH4Cl��Һ��15C���µ�25��Cʱ��![]() ��ֵ����
��ֵ����
C.��ӦNH4Cl+NaNO2=NaCl+N2��+2H2O��ÿ����1molN2ת�Ƶ�����Ϊ6��6.02��1023
D.�����£�Ksp[Mg(OH)2]=1.8x10-11��Kb(NH3��H2O)=1.8x10-5��NH4Cl������Һ�м�������Mg(OH)2�����������ܽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
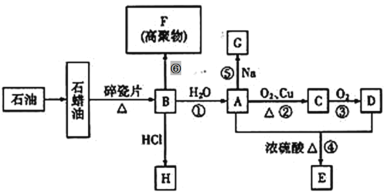
����Ŀ����֪A�ǻ�ѧʵ������������л����������ˮ����������ζ��B�IJ������Ժ���һ������ʯ�ͻ�����չ��ˮƽ���й����ʵ�ת����ϵ��ͼ��ʾ���ַ�Ӧ����������ʡ����
�ش��������⣺
��1����ҵ����ʯ���ͻ��B�ķ�����Ϊ___________��
��2���پ���������A�Ļ�ѧ���Ե�ԭ���ŵ�����Ϊ___________��
��B��A�ķ�Ӧ����Ϊ___________��A��E�ķ�Ӧ����Ϊ___________��
��3��д�����з�Ӧ�Ļ�ѧ����ʽ��
��Ӧ�ڣ�___________
��Ӧ�ޣ�___________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ��ˮ��ʯ(þ�����ļ�ʽ̼����)�Ǿ��в�״�ṹ�������ܲ��ϣ�����Mg(NO3)2��6H2O��Fe(NO3)3��9H2O��CO(NH2)2�Ȱ�һ���������¶ȸ���90��ʱ��Ӧ�Ƶá�
(1)������������ʱ��n[CO(NH2)2]/n(Fe3+)��þ��ˮ��ʯ���ʺ���ҺpH�ı仯��ϵ��ͼ��ʾ��
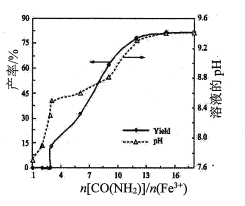
��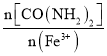 <3����ӦҺ�в����������壬�ⰱ��δ���NH3��˵���ݳ���������Ҫ��____________(�ѧʽ)��
<3����ӦҺ�в����������壬�ⰱ��δ���NH3��˵���ݳ���������Ҫ��____________(�ѧʽ)��
��n[CO(NH2)2]/n(Fe3+)>12����Һ��pH�����ȶ�״̬��������Ϊ_________________
(2)þ��ˮ��ʯ��ʾΪ��[FexMgy(OH)z](CO3)w��pH2O(Ħ������Ϊ660g��mol-1)����ͨ������ʵ�����������ȷ���仯ѧʽ���������£�
I��ȡþ��ˮ��ʯ3.300g��������ϡ�����ַ�Ӧ���ռ�������112mL(��״��)��
II�����ײ��þ��ˮ��ʯ�ȷֽ�TG-DSCͼ��303~473K��ʧȥ���ˮ(�ᾧˮ)ʧ��Ϊ10.9%��473~773Kʱ��CO32-��OH-�ֽ�ΪCO2��H2O��773K���ϲ���ΪMgO��Fe2O3��
��ȡ0.4000g�ȷֽ����(773K����)���ڵ���ƿ�У������Թ�������ʹ����ȫ�ܽ⣬��������ˮ���Թ�����KI��Һ���ڰ�������Ƭ�̣���0.1000mol��L-1Na2S2O3����Һ�ζ�����Һ�ʵ���ɫ������3mL������Һ�������ζ�����Һ��ɫ��ʧ��(2Na2S2O3+I2=2NaI+Na2S4O6)������Na2S2O3��Һ20.00mL��ͨ������ȷ��þ��ˮ��ʯ�Ļ�ѧʽ______________(д���������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�鷽�������ﵽ��ӦĿ�ĵ���
A | B | C | D | |
Ŀ�� | �Ƚ�̼�����̼�����ˮ��̶� | �о�Ũ�ȶԻ�ѧƽ���Ӱ�� | �Ƚϲ�ͬ�����Ի�ѧ��Ӧ���ʵ�Ӱ�� | �Ƚ�̼�ᡢ��������������ǿ�� |
ʵ�鷽�� |
|
|
|
|
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��2H2(g) +O2(g)��2H2O(g) ��H =��483.6 kJmol-1
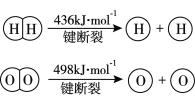
����˵������ȷ����
A. �÷�Ӧ����Ϊ����ȼ�ϵ�صķ�Ӧԭ��
B. �ƻ�1mol H-O����Ҫ��������463.4 kJ
C. H2O(g)��H2(g) +1/2O2(g) ��H = +241.8 kJmol-1
D. H2(g)�е�H-H����H2O(g)�е�H-O���ι�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��2SO3(g)![]() 2SO2(g)+O2(g)�������仯ͼ����ͼ�ó������������ȷ����( )
2SO2(g)+O2(g)�������仯ͼ����ͼ�ó������������ȷ����( )
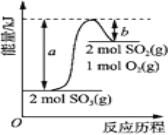
A. �û�ѧ��Ӧ�����м������������������������ͷ�
B. 2SO3(g)![]() 2SO2(g)+O2(g) ��H����(a��b) kJ��mol
2SO2(g)+O2(g) ��H����(a��b) kJ��mol
C. 1 mol SO2��������1 mol SO3��������
D. ��ij��������2 mol SO3��ַ�Ӧ������(a��b) kJ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
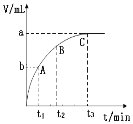
����Ŀ��ijʵ��С���H2O2�ֽⷴӦ����ʵ��̽�������������״̬��ͬ��MnO2�ֱ����ʢ�е������Ũ�ȵ�H2O2��Һ�Ĵ��Թ��У����ô����ǵ�ľ�����Թܿڲ��ԡ��йؼ�¼���£�
MnO2 | �����Թ� | ���� | ��Ӧʱ��/min |
��ĩ | ���� | ��Ӧ���ң������ǵ�ľ��Ѹ�ٸ�ȼ | t1 |
��״ | �� | ��Ӧ���������Ǻ�����ľ��δ��ȼ | t2 |
(1)�Թ��л�ѧ��Ӧ����ʽ��____________��
(2)ʵ����֤���˴����Ĵ�Ч����____________�йء�
(3)����t1____________t2(���>������<����=��)
(4)���Ƹ÷�Ӧ���ʣ����˸ı�������أ����еķ�������____________��
(5)ijͬѧ��һ��Ũ�ȵ�H2O2��Һ10mL����������MnO2��ij�¶��·�Ӧ�������ų���������(��״��)�뷴Ӧʱ��Ĺ�ϵ��ͼ��ʾ����A��B��C��������ʾ�ļ�ʱ��Ӧ������������____________�㡣
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com