
【题目】化学电源在生产生活中有着广泛的应用,请回答下列问题:
(1)电动汽车上用的铅蓄电池是以一组充满海绵状态铜的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解液。放电时总反应为:Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O
① 写出放电时负极的电极反应式:______________________________;
② 铅蓄电池放电时,溶液的pH将_________(填增大、减小或不变)。当外电路上有0.5mol电子通过时,溶液中消耗H2SO4的物质的量为___________。
③ 放电完后,对该电池进行充电,在连接电源的负极一端生成________。(填“Pb”或“PbO2”)
(2)下图是某宇宙飞船中使用的氢氧燃料电池。其导电介质为KOH,总反应为:2H2 + O2=2H2O。
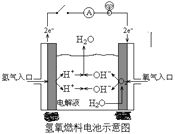
① 则负极通入的是_______,(填“H2”或“O2”)负极电极反应式为:_______________________,正极电极反应式为:______________________。
②如把导电介质改为稀H2SO4,则电极反应式为:负极__________________,正极______________。
【答案】 Pb -2e- + SO42- = PbSO4 增大 0.5mol Pb H2 H2 -2e- + 2OH- =2H2O O2 + 4e- + 2H2O = 4OH- H2 – 2e- = 2H+ O2 + 4H+ + 4e- = 2H2O
【解析】(1)①因为放电时总反应为:Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O,Pb失电子发生负极反应,产生的Pb2+在H2SO4溶液中结合SO42-生成难溶于水的PbSO4,故其负极反应式为:Pb -2e- + SO42- = PbSO4;②根据电池反应式知,硫酸参加反应,且反应中生成水,导致溶液中氢离子浓度减小,则溶液的pH增大;根据反应Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O,转移2mol电子时,消耗2mol H2SO4,当外电路上有0.5mol电子通过时,溶液中消耗H2SO4的物质的量为0.5mol;③ 放电完后,对该电池进行充电,在连接电源的负极一端是阴极,阴极发生的电极反应式为:PbSO4 +2e- = Pb + SO42-,则阴极上生成Pb;
(2)① 则负极通入的是H2,碱性条件下氢气失去电子生成的氢离子与氢氧根离子结合生成水,则负极电极反应式为:H2 -2e- + 2OH- =2H2O;正极氧气得电子产生氢氧根离子,电极反应式为:O2 + 4e- + 2H2O = 4OH-;②如把导电介质改为稀H2SO4,酸性条件下氢气在负极失电子产生氢离子,电极反应式为:H2 – 2e- = 2H+;氧气在正极得电子产生的氢氧根离子与氢离子结合生成水,电极反应式为:O2 + 4H+ + 4e- = 2H2O。


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】硅在氧气中完全燃烧的化学方程式为:Si+O2 ![]() SiO2 , 1molSi完全燃烧生成SiO2放出992kJ的热量.已知断裂1molSi﹣Si键、1molO=O键和1molSi﹣O键吸收的能量分别为176kJ、496kJ、460kJ.晶体结构知识告诉我们,1molSiO2中含有4molSi﹣O键,则1molSi中含有Si﹣Si键的物质的量为( )
SiO2 , 1molSi完全燃烧生成SiO2放出992kJ的热量.已知断裂1molSi﹣Si键、1molO=O键和1molSi﹣O键吸收的能量分别为176kJ、496kJ、460kJ.晶体结构知识告诉我们,1molSiO2中含有4molSi﹣O键,则1molSi中含有Si﹣Si键的物质的量为( )
A.1mol
B.2mol
C.3mol
D.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废水中可能含有如下几种阴阳离子:
阳离子 | Fe3+、Al3+、Fe2+、Ba2+、Na+ |
阴离子 | Cl-、CO32-、NO3-、SO42-、S2- |
现对该废水样品进行以下研究:
Ⅰ.向试管中滴加浓盐酸,有少量的无色气体生成,气体遇空气立即变为红棕色;
Ⅱ.若向Ⅰ所得的溶液中加入BaCl2溶液,有白色沉淀生成。
Ⅲ.若向Ⅰ所得的溶液中加入过量的NaOH溶液,有红褐色沉淀生成。过滤后向所得滤液中通入过量的CO2气体,有白色絮状沉淀生成。
根据上述实验,回答下列问题:
(1)该废水中一定含有的阴离子是 _____,一定不含有的阳离子是_____;
(2)写出Ⅰ中产生无色气体的反应的离子方程式:______;
(3)写出Ⅲ中通入过量CO2产生白色絮状沉淀所发生的反应离子方程式:______;
(4)在废水中加入新制氯水,测得溶液中c(Fe3+)=1.0×10-2mol·L-1,c(Al3+)=1.0×10-3mol·L-1。要想使Fe3+完全沉淀(离子浓度为1.0×10-5mol·L-1)而Al 3+不沉淀,则应调节溶液pH范围为______。(已知常温下Fe(OH)3的Ksp=1.0×10-38,Al(OH)3的Ksp=1.0×10-33)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3 、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:NH3 + CO2 + H2O = NH4HCO3 ; NH4HCO3 + NaCl = NaHCO3↓+ NH4Cl ; 2NaHCO3 = Na2CO3 + CO2↑+ H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是__________ (填标号)。
A.碳酸氢钠难溶于水 B.碳酸氢钠受热易分解
C.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。

试回答下列有关问题:
(Ⅰ)乙装置中的试剂是___________;
(Ⅱ)丁装置中稀硫酸的作用是_____________________________________。
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是__________ (填分离操作的名称)。
②另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从____管通入_______ 气体,再从_____管中通入________气体。
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是_____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下对影响反应方向因素的判断不正确的是( )
A. 有时焓变对反应的方向起决定性作用
B. 有时熵变对反应的方向起决定性作用
C. 焓变和熵变是判断反应方向的两个主要因素
D. 任何情况下,温度都不可能对反应的方向起决定性作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq) + Cu(s) = Cu2+(aq) + 2Ag(s)设计的原电池如图所示,请回答下列问题:
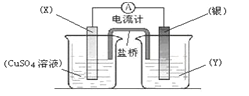
(1)电极X的材料是:________(填化学式);电解质溶液Y是:_________;
(2)银电极为电池的_______极,发生的电极反应为:___________________,X电极上发生的电极反应为:_____________________________________;
(3)外电路中的电子是从_________电极流出(填“X”或“银”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压,高铁电池的总反为:3Zn+2K2FeO4+8H2O ![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
A.放电时负极反应式为:Zn﹣2e﹣+2OH﹣=Zn(OH)2
B.放电时每转移3mol电子,正极有1 mol K2FeO4被还原
C.充电时阴极附近溶液的碱性增强
D.放电时正极反应式为:Fe(OH)3﹣3e﹣+5OH﹣=FeO42﹣+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 镁常用于制造信号弹和焰火
B. 碘化银和干冰常用于人工降雨
C. 二氧化硅常用于制造太阳能电池
D. 钠不慎着火时,不能用泡沫灭火剂灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁分别是Al2(SO4)3、FeSO4、NaOH、BaCl2四种物质中的一种,若将乙溶液滴入丁溶液,没有现象,继续滴加一段时间后,出现白色沉淀,再滴加,沉淀不消失,丁溶液滴入甲溶液时,无明显现象发生,据此可推断丙物质是( )
A.Al2(SO4)3B.FeSO4C.BaCl2D.NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com