
【题目】某工业废水中可能含有如下几种阴阳离子:
阳离子 | Fe3+、Al3+、Fe2+、Ba2+、Na+ |
阴离子 | Cl-、CO32-、NO3-、SO42-、S2- |
现对该废水样品进行以下研究:
Ⅰ.向试管中滴加浓盐酸,有少量的无色气体生成,气体遇空气立即变为红棕色;
Ⅱ.若向Ⅰ所得的溶液中加入BaCl2溶液,有白色沉淀生成。
Ⅲ.若向Ⅰ所得的溶液中加入过量的NaOH溶液,有红褐色沉淀生成。过滤后向所得滤液中通入过量的CO2气体,有白色絮状沉淀生成。
根据上述实验,回答下列问题:
(1)该废水中一定含有的阴离子是 _____,一定不含有的阳离子是_____;
(2)写出Ⅰ中产生无色气体的反应的离子方程式:______;
(3)写出Ⅲ中通入过量CO2产生白色絮状沉淀所发生的反应离子方程式:______;
(4)在废水中加入新制氯水,测得溶液中c(Fe3+)=1.0×10-2mol·L-1,c(Al3+)=1.0×10-3mol·L-1。要想使Fe3+完全沉淀(离子浓度为1.0×10-5mol·L-1)而Al 3+不沉淀,则应调节溶液pH范围为______。(已知常温下Fe(OH)3的Ksp=1.0×10-38,Al(OH)3的Ksp=1.0×10-33)
【答案】 NO3—,SO42- Ba2+ 3Fe2++ NO3—+4H+ =3Fe2+NO↑+2H2O AlO2-+CO2+2H2O= Al(OH)3↓+HCO3- 3≤pH≤4
【解析】本题主要考查离子的检验。
Ⅰ.红棕色气体是二氧化氮,废水含有NO3-和还原性离子Fe2+、S2-中的一种;
Ⅲ.红褐色沉淀是氢氧化铁,表明废水含有铁元素的离子,白色絮状沉淀是氢氧化铝,表明废水含有Al3+。相应地不含有与Fe3+或Fe2+或Al3+发生反应的S2-、CO32-。
Ⅱ.白色沉淀是硫酸钡,废水含有SO42-。相应地不含有与SO42-发生反应的Ba2+。
(1)该废水中一定含有的阴离子是NO3-、SO42-,一定不含有的阳离子是Ba2+;
(2)Ⅰ中产生无色气体的反应是稀硝酸与Fe2+的反应,反应的离子方程式:3Fe2++NO3-+4H+=3Fe2+NO↑+2H2O;
(3)Ⅲ中通入过量CO2产生白色絮状沉淀,同时生成碳酸氢钠,所发生反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)要想使Fe3+完全沉淀就是控制c(Fe3+)≤1.0×10-5mol·L-1,则要求c(OH-)≥(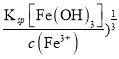 =1.0×10-11mol·L-1,pH≥3,Al3+不沉淀,c(Al3+)=1.0×10-3mol·L-1,则要求c(OH-)≤(
=1.0×10-11mol·L-1,pH≥3,Al3+不沉淀,c(Al3+)=1.0×10-3mol·L-1,则要求c(OH-)≤(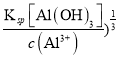 =1.0×10-10mol·L-1,pH≤4,总之,应调节溶液pH范围为3≤pH≤4。
=1.0×10-10mol·L-1,pH≤4,总之,应调节溶液pH范围为3≤pH≤4。


科目:高中化学 来源: 题型:
【题目】目前人类已发现几千万种物质,对物质进行分类,有利于我们的学习,下列物质的分类不正确的是
A.SO2(氧化物)B.稀硫酸(电解质)C.HNO3(含氧酸)D.氯水(混合物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B为两种短周期元素,A的原子序数大于B,且B原子的最外层电子数为A原子最外层电子数的3倍。A、B形成的化合物是中学化学常见的化合物,该化合物熔融时能导电,试回答下列问题:
(1)A、B的元素符号分别是________、________。
(2)写出A、B元素形成化合物电子式:___________。
(3)A、B所形成的化合物的晶体结构与氯化钠晶体结构相似,则每个阳离子周围吸引了________个阴离子;晶体中阴、阳离子数之比为 ________。
(4)A、B所形成化合物的晶体的熔点比NaF晶体的熔点________(填“高”或“低”),其判断的理由是 ____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、社会发展息息相关。下列说法正确的是
A. 有人称“一带一路”是“现代丝绸之路”,丝绸的主要成分是纤维素
B. 聚乳酸酯的降解和油脂的皂化都是高分子生成小分子的过程
C. 疫苗一般应冷藏存放,其目的是避免蛋白质变性
D. “玉兔二号”的太阳能电池帆板的材料是二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向硫酸铜水溶液中逐滴加入氨水,先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,再向溶液中加入乙醇有深蓝色晶体(化学式为[Cu(NH3)4]SO4·H2O)析出。
(1)铜元素基态原子的电子排布式为_________________,铜单质晶体中的原则堆积模型属于_________堆积(填堆积模型名称)。
(2)在上述深蓝色晶体的阴离子的立体构型是_________,阴离子的中心原子的杂化方式为_________。
(3)氨的沸点高于膦(PH2),原因是_____________。
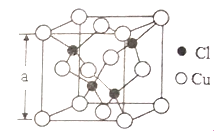
(4)Cu的一种氯化物晶胞结构如右图所示,该氯化物的化学式是______________。若该晶体的密度为pg·cm-3,以NA表示阿伏伽德罗常数,则该晶胞的边长为a=_____________nm。(3分)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电源在生产生活中有着广泛的应用,请回答下列问题:
(1)电动汽车上用的铅蓄电池是以一组充满海绵状态铜的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解液。放电时总反应为:Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O
① 写出放电时负极的电极反应式:______________________________;
② 铅蓄电池放电时,溶液的pH将_________(填增大、减小或不变)。当外电路上有0.5mol电子通过时,溶液中消耗H2SO4的物质的量为___________。
③ 放电完后,对该电池进行充电,在连接电源的负极一端生成________。(填“Pb”或“PbO2”)
(2)下图是某宇宙飞船中使用的氢氧燃料电池。其导电介质为KOH,总反应为:2H2 + O2=2H2O。
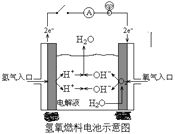
① 则负极通入的是_______,(填“H2”或“O2”)负极电极反应式为:_______________________,正极电极反应式为:______________________。
②如把导电介质改为稀H2SO4,则电极反应式为:负极__________________,正极______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产生活密切相关,下列有关说法不正确的是( )
A.富脂食品包装中常放入活性铁粉袋,以防止油脂氧化变质
B.“黑陶”是一种传统工艺品,是用陶土烧制而成,其主要成分为硅酸盐
C.我国预计2020年发射首颗火星探测器,太阳能电池帆板的材料是二氧化硅
D.用K2FeO4代替Cl2处理饮用水时,既有杀菌消毒作用,又有净水作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com