
����Ŀ��������ͭˮ��Һ����μ��백ˮ�����γ���ɫ�����������μӰ�ˮ�������ܽ⣬�õ�����ɫ������Һ��������Һ�м����Ҵ�������ɫ���壨��ѧʽΪ[Cu(NH3)4]SO4��H2O��������
(1)ͭԪ�ػ�̬ԭ�ӵĵ����Ų�ʽΪ_________________��ͭ���ʾ����е�ԭ��ѻ�ģ������_________�ѻ�����ѻ�ģ�����ƣ���
(2)����������ɫ����������ӵ����幹����_________�������ӵ�����ԭ�ӵ��ӻ���ʽΪ_________��
(3)���ķе�����(PH2)��ԭ����_____________��
(4)Cu��һ���Ȼ��ᄃ���ṹ����ͼ��ʾ�����Ȼ���Ļ�ѧʽ��______________�����þ�����ܶ�Ϊpg��cm-3����NA��ʾ����٤����������þ����ı߳�Ϊa=_____________nm��(3��)
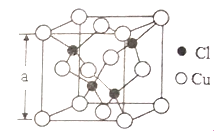
���𰸡� 1s22s22p63s23p63d104s1�� 3d104s1 �����������ܶѻ� �������� sp3 ���Ӽ���������좷��Ӽ䲻���������ֻ���ڷ��»������ʰ��ķе����좵ķе� CuCl ![]()
![]()
����������1��ͭԪ�ص�ԭ��������29����̬ԭ�ӵĵ����Ų�ʽΪ1s22s22p63s23p63d104s1��[Ar] 3d104s1��ͭ���ʾ����е�ԭ�Ӷѻ�ģ�����������������ܶѻ��ѻ�����2���þ����е�����������������ӣ�����ԭ��Sԭ�ӵļ۲���Ӷ�����4���Ҳ����ڹ¶Ե��ӣ����������幹�����������壬�����ӵ�����ԭ�ӵ��ӻ���ʽΪ sp3����3�����Ӽ���������좷��Ӽ䲻���������ֻ���ڷ��»������ʰ��ķе����좵ķе㣻��4����������ԭ�ӵĸ�����4����ͭԭ�ӵĸ�����8��1/8+6��1/2��4�����Ի�ѧʽΪCuCl������m��V�ѿ�֪a3p��![]() �����a��
�����a�� ��
�� nm��
nm��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ֱ��ʾ�йط�Ӧ�ķ�Ӧ�����������仯�Ĺ�ϵ��
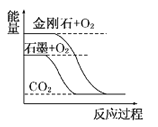

�ݴ��ж�����˵������ȷ����(����)
A. ʯīת��Ϊ���ʯ�����ȷ�Ӧ B. ���ױȺ����ȶ�
C. S(g)��O2(g)===SO2(g)����H1S(s)��O2(g)=SO2(g)����H2������H1>��H2 D. CO(g)��H2O(g)=CO2(g)��H2(g)����H>0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������¸�ʴ������
A. �����뺣ˮ�� B. ������п���Ӻ���뵽��ˮ��
C. ������п���Ӻ���뵽��ˮ�� D. �����������Ӻ���뵽��ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ҵ��ˮ�п��ܺ������¼����������ӣ�
������ | Fe3+��Al3+��Fe2+��Ba2+��Na+ |
������ | Cl����CO32����NO3����SO42����S2�� |
�ֶԸ÷�ˮ��Ʒ���������о���
�����Թ��еμ�Ũ���ᣬ����������ɫ�������ɣ�����������������Ϊ����ɫ��
����������õ���Һ�м���BaCl2��Һ���а�ɫ�������ɡ�
����������õ���Һ�м��������NaOH��Һ���к��ɫ�������ɡ����˺���������Һ��ͨ�������CO2���壬�а�ɫ��״�������ɡ�
��������ʵ�飬�ش��������⣺
��1���÷�ˮ��һ�����е��������� _____��һ�������е���������_____��
��2��д�����в�����ɫ����ķ�Ӧ�����ӷ���ʽ��______��
��3��д������ͨ�����CO2������ɫ��״�����������ķ�Ӧ���ӷ���ʽ��______��
��4���ڷ�ˮ�м���������ˮ�������Һ��c(Fe3+)��1.0��10��2mol��L��1��c(Al3+)��1.0��10��3mol��L��1��Ҫ��ʹFe3+��ȫ����������Ũ��Ϊ1.0��10��5mol��L��1����Al 3+����������Ӧ������ҺpH��ΧΪ______������֪������Fe(OH)3��Ksp��1.0��10��38��Al(OH)3��Ksp��1.0��10��33��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ռ�ʵ���ҡ��칬һ�š��Ĺ���ϵͳ������������ȼ�ϵ��(RFC)��RFC��һ�ֽ�ˮ��⼼��������ȼ�ϵ�ؼ�������ϵĿɳ���ء���ͼΪRFC����ԭ��ʾ��ͼ���й�˵����ȷ����( )

A������0.1 mol����ת��ʱ��a������1.12 L O2(���)
B��b���Ϸ����ĵ缫��Ӧ�ǣ�2H![]() �� 2e�� = H2��
�� 2e�� = H2��
C��d���Ϸ����ĵ缫��Ӧ�ǣ�O2 �� 4H�� �� 4e�� = 2H2O
D��c���Ͻ��л�ԭ��Ӧ��B�е�H������ͨ����Ĥ����A
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�����ר�Һ�°�ġ������Ƽ����Ϊ�����Ƽҵ������ͻ�����ס�����NaCl��NH3 ��CO2��Ϊԭ�����Ƶ�NaHCO3����������������йط�Ӧ�Ļ�ѧ����ʽΪ��NH3 + CO2 + H2O = NH4HCO3 �� NH4HCO3 + NaCl = NaHCO3��+ NH4Cl �� 2NaHCO3 = Na2CO3 + CO2��+ H2O
��1��̼������뱥��ʳ��ˮ��Ӧ��������̼�����ƾ����ԭ����__________ �����ţ���
A��̼������������ˮ B��̼�����������ֽ�
C��̼�����Ƶ��ܽ����Խ�С����������Һ�����Ƚᾧ����
��2��ij̽���С����������Ƽ�ԭ��������̼�����Ƶ��Ʊ�ʵ�飬ͬѧ�ǰ�������Ƶķ���ʵ�顣
�� һλͬѧ��������̼����ͨ�뺬���ı���ʳ��ˮ���Ʊ�̼�����ƣ�ʵ��װ������ͼ��ʾ��ͼ�мг֡��̶��õ�����δ��������

�Իش������й����⣺
������װ���е��Լ���___________��
����װ����ϡ�����������_____________________________________��
����ʵ����������NaHCO3 ����IJ�����__________ ���������������ƣ���
����һλͬѧ��ͼ����װ�ã�����װ��δ����������ʵ����
����ʵ��ʱ�����ȴ�____��ͨ��_______ ���壬�ٴ�_____����ͨ��________���塣
������ͬѧ��������װ�õ�b���¶����Ӽ�װ�ã�������_____________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����¶�Ӱ�췴Ӧ�������ص��жϲ���ȷ������ ��
A. ��ʱ�ʱ�Է�Ӧ�ķ��������������
B. ��ʱ�ر�Է�Ӧ�ķ��������������
C. �ʱ���ر����жϷ�Ӧ�����������Ҫ����
D. �κ�����£��¶ȶ������ܶԷ�Ӧ�ķ��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������һ�����Ϳɳ���أ�����ͨ���ܵ����ȣ��õ���ܳ�ʱ�䱣���ȶ��ķŵ��ѹ��������ص��ܷ�Ϊ��3Zn+2K2FeO4+8H2O ![]() 3Zn��OH��2+2Fe��OH��3+4KOH��������������ȷ���ǣ� ��
3Zn��OH��2+2Fe��OH��3+4KOH��������������ȷ���ǣ� ��
A.�ŵ�ʱ������ӦʽΪ��Zn��2e��+2OH��=Zn��OH��2
B.�ŵ�ʱÿת��3mol���ӣ�������1 mol K2FeO4����ԭ
C.���ʱ����������Һ�ļ�����ǿ
D.�ŵ�ʱ������ӦʽΪ��Fe��OH��3��3e��+5OH��=FeO42��+4H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����N2�� H2��һ��������ϣ�����ͬ״�������ܶ���H2��3.6����ȡ0.5mol�û������ͨ���ܱ������ڣ�ʹ֮������Ӧ����һ�������´ﵽƽ�⣮��֪��Ӧ�ﵽƽ���������ѹǿ����ͬ�����·�Ӧǰѹǿ��0.76��������
��1����Ӧǰ��������ƽ����Է�������Ϊ������N2�� H2������ȵ�����
��2���ﵽƽ��ʱ��������еİ������ʵ�������
��3��ƽ��ʱN2��ת���ʵ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com