
【题目】空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确的是( )

A.当有0.1 mol电子转移时,a极产生1.12 L O2(标况)
B.b极上发生的电极反应是:2H![]() + 2e- = H2↑
+ 2e- = H2↑
C.d极上发生的电极反应是:O2 + 4H+ + 4e- = 2H2O
D.c极上进行还原反应,B中的H+可以通过隔膜进入A
【答案】D
【解析】
试题分析:由图可知左边是电解池,右边是原电池,ab是电解池的电极,由电源判断a为阴极产生氢气,b为阳极产生氧气;cd是原电池的正负极,c是正极,d是负极; A、当有0.1 mol电子转移时,a电极为阴极,发生反应:4H + +4e - =2H 2 ↑,产生1.12LH 2 ,A错误;B、b电极为阳极,发生反应:4OH - -4e - =2H 2 O+O 2↑,B错误;C、d为负极,发生反应:2H 2 -4e - =4H + ,C错误;D、c电极为正极,得到电子发生还原反应:O 2 +4H + +4e - =2H 2 O,d为负极,发生反应:2H 2 -4e - =4H + ,B中的H + 可以通过隔膜进入A,D正确。答案选D。


科目:高中化学 来源: 题型:
【题目】保护环境是我国的一项基本国策,下列做法不应该提倡的是( )
A.出门尽可能步行骑行或坐公交B.深入农村和社区进行环保宣传
C.吃快餐时尽量不要用塑料袋D.用过的废旧电池埋到田地里。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq) + Cu(s) = Cu2+(aq) + 2Ag(s)设计的原电池如图所示,请回答下列问题:

(1)电极X的材料是:________(填化学式);电解质溶液Y是:_________;
(2)银电极为电池的_______极,发生的电极反应为:___________________,X电极上发生的电极反应为:_____________________________________;
(3)外电路中的电子是从_________电极流出(填“X”或“银”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B为两种短周期元素,A的原子序数大于B,且B原子的最外层电子数为A原子最外层电子数的3倍。A、B形成的化合物是中学化学常见的化合物,该化合物熔融时能导电,试回答下列问题:
(1)A、B的元素符号分别是________、________。
(2)写出A、B元素形成化合物电子式:___________。
(3)A、B所形成的化合物的晶体结构与氯化钠晶体结构相似,则每个阳离子周围吸引了________个阴离子;晶体中阴、阳离子数之比为 ________。
(4)A、B所形成化合物的晶体的熔点比NaF晶体的熔点________(填“高”或“低”),其判断的理由是 ____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3,又名三氯化铁,是黑棕色结晶,主要用于金属蚀刻,污水处理。解答下列问题。
(1)按照物质的分类方法,FeCl3应属于_______________________。
①酸 ②氯化物 ③混合物 ④盐 ⑤化合物 ⑥电解质 ⑦易溶于水物质
A.②③④⑤⑥⑦ B.①④⑥⑦ C.②④⑤⑥⑦ D.④⑤⑥⑦
(2)0.1mol/LFeCl3溶液中c(Cl-)=_______mol/L。测得200mL某浓度FeCl3溶液中Cl-的质量为21.3g,则此溶液中c(Fe3+) =_______mol/L.
(3)将饱和FeCl3溶液逐滴加入沸水中,继续煮沸可制取氢氧化铁胶体,氢氧化铁胶体可处理污水,该反应的化学方程式为__________________;高铁酸钠Na2FeO4是一种新型水处理剂,用FeCl3制备的离子方程式如下,请完成该方程式的配平:___Fe3++_____Cl 2+_____OH-=_____FeO42-+_____Cl-+_____H2O
(4)FeCl3还可用于有机物的鉴别,已知芳香族化合物A、B、C的分子式均为C7H8O
A | B | C | |
加入氯化铁溶液 | 显紫色 | 无明显现象 | 无明显现象 |
加入钠 | 放出氢气 | 放出氢气 | 不反应 |
苯环上一氯代物的种数 | 2 | 3 | 3 |
则B的结构简式为____,A与浓溴水反应的方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向硫酸铜水溶液中逐滴加入氨水,先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,再向溶液中加入乙醇有深蓝色晶体(化学式为[Cu(NH3)4]SO4·H2O)析出。
(1)铜元素基态原子的电子排布式为_________________,铜单质晶体中的原则堆积模型属于_________堆积(填堆积模型名称)。
(2)在上述深蓝色晶体的阴离子的立体构型是_________,阴离子的中心原子的杂化方式为_________。
(3)氨的沸点高于膦(PH2),原因是_____________。
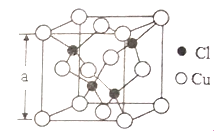
(4)Cu的一种氯化物晶胞结构如右图所示,该氯化物的化学式是______________。若该晶体的密度为pg·cm-3,以NA表示阿伏伽德罗常数,则该晶胞的边长为a=_____________nm。(3分)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是2SO2(g) + O2(g) = 2SO3(g)反应过程中的能量变化, 已知1mol SO2(g)完全氧化为1mol SO3的ΔH= —99kJ·mol-1,请回答下列问题:
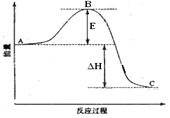
(1)图中A、C分别表的物质是__________________、________________,E的大小对该反应的焓变有无影响?___________(填“有”或“无”)(该反应通常用V2O5作催化剂,加V2O5会使图中B点降低。);
(2)图中△H = _____________kJ·mol-1;
(3)已知:S(s) + O2(g) = SO2(g) ΔH=-296 kJ·mol-1,计算由3 mol S(s)与氧气反应生成3 molSO3(g)的△H = ______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池构造如图所示,下列说法不正确的是( ) 
A.负极反应为:Cu﹣2e﹣═Cu2+
B.若该原电池工作前两电极质量相等,则工作后,当铜的质量减少6.4g时,两电极质量相差21.6g(假设电解质溶液都是足量的)
C.当铜的质量减小12.8 g时,外电路中通过0.4mol电子
D.原电池的总反应式为:Cu+2AgNO3═2Ag+Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学科学对提高人类生活质量和促进社会发展具有重要作用,下列说法中正确的是( )
A.煤经过气化和液化两个物理变化,可变为清洁能源
B.汽车尾气的大量排放影响了空气的质量,是造成PM2.5值升高的原因之一
C.自然界中含有大量的游离态的硅,纯净的硅晶体可用于制作计算机芯片
D.糖类、油脂和蛋白质都能发生水解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com