
【题目】只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是
A. K值不变,平衡可能移动 B. K值变化,平衡一定移动
C. 平衡移动,K值可能不变 D. 平衡移动,K值一定变化
 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
【题目】碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型髙效絮凝剂,在医药上也可于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的流程如下:
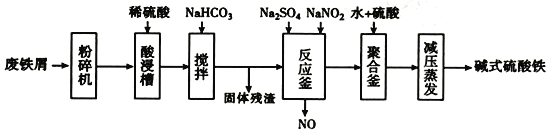
已知:
部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
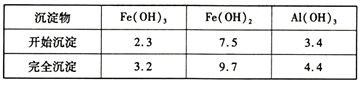
回答下列问题:
(1)粉碎过筛的目的是____________________。
(2)加入少量NaHCO3的目的是________。
(3)反应釜中发生反应的离子方程式为_______________________。在实际生产中,常同时通入02以减少NaNO2的用量,若参与反应的O2有11.2L(标准状况),则相当于约NaNO2的物质的量为________。
(4)聚合釜中溶液的PH必须控制在一定的范围内。PH偏小时Fe3+水解程度弱,PH偏大时则_____________________________________。
(5)采取减压蒸发的原因是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:

①某同学根据上述信息,推断B的核外电子排布如下图所示,该同学所画的电子排布图违背_________,B元素位于周期表五个区域中的__________________区。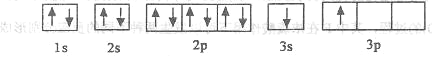
② ACl2分子中A的杂化类型为_________,ACl2的空间构型为_________。
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①以体心立方堆积形成的金属铁中,其原子的配位数为__________________。
②写出一种与CN—互为等电子体的单质的电子式____________。
③六氰合亚铁离子[Fe(CN)6]4—中不存在__________________。
A.共价键 B.非极性键 C.配位键 D.σ键 E.π键
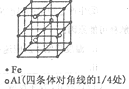
(3)一种Al-Fe合金的立体晶胞如右图所示。请据此回答下列问题:
①确定该合金的化学式__________________。
②若晶体的密度=ρg/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为______cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列情况会对人体健康造成较大危害的是
A. 使用SO2漂白银耳
B. 自来水中通入少量Cl2进行消毒杀菌
C. 用食醋清洗热水瓶胆内壁附着的水垢
D. 用小苏打焙制糕点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出[Ag(NH3)2]OH的中心离子的核外电子排布式________、配位体的电子式________、配位体的杂化方式是________写出[Ag(NH3)2]OH电离的离子方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:

供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸。
(1)操作①的名称是_________。
(2)试剂a是_________,试剂b 是_________ 。
(3)加入试剂a所发生反应的离子方程式为_________。
加入试剂b所发生反应的离子方程式为_________。
(4)该方案能否达到实验目的:_____(填“能”或“不能”)。若不能,应如何改进? _____(若能,此问不用回答).
(5)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外。至少还要获得的数据是_________的质量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计)。其中能表示等质量的氢气与氦气的是( )
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下向不同电解质溶液中加入新物质时溶液的导电性能发生变化,如下图所示是其电流(I)随新物质加入量(m)的变化曲线。

以下4个导电性实验,其中与图Ⅰ、图Ⅱ、图Ⅲ对应一致的选项是
①Ba(OH)2溶液中滴入H2SO4溶液至过量
②醋酸溶液中滴入NH3·H2O至过量
③澄清石灰水中通入CO2至过量
④NH4Cl溶液中逐渐加入适量NaOH固体

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。
![]()
![]()
![]()
![]()
![]()
回答下列问题:
(1)为尽量少引入杂质,试剂①应选用NaOH溶液,若选用H2SO4溶液,其后果是________________________ 。
(2)易拉罐溶解过程中主要反应的化学方程式为____________________________;滤液A中的某种离子与NH4+、HCO3-均能反应生成沉淀B,该离子与NH4+反应的离子方程式为_____________________________________________。
(3)明矾与硫磺焙烧时发生反应的化学方程式为:KAl(SO4)2·12H2O+S![]() K2SO4+Al2O3+SO2↑+H2O(未配平),配平后的化学计量数依次为___________________________;每生成67.2L标准状况下的SO2,转移电子的物质的量为________;焙烧产生的SO2经催化氧化、吸收等过程可制得硫酸,若SO2催化氧化时的转化率为96.0%,则理论上用该法生成硫酸时硫元素的总转化率为__________。
K2SO4+Al2O3+SO2↑+H2O(未配平),配平后的化学计量数依次为___________________________;每生成67.2L标准状况下的SO2,转移电子的物质的量为________;焙烧产生的SO2经催化氧化、吸收等过程可制得硫酸,若SO2催化氧化时的转化率为96.0%,则理论上用该法生成硫酸时硫元素的总转化率为__________。
(4)实验室需要用1mol/L的KAl(SO4)2溶液225ml,用明矾配制用到的玻璃仪器有____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com