
【题目】(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:

①某同学根据上述信息,推断B的核外电子排布如下图所示,该同学所画的电子排布图违背_________,B元素位于周期表五个区域中的__________________区。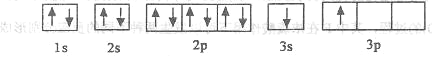
② ACl2分子中A的杂化类型为_________,ACl2的空间构型为_________。
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①以体心立方堆积形成的金属铁中,其原子的配位数为__________________。
②写出一种与CN—互为等电子体的单质的电子式____________。
③六氰合亚铁离子[Fe(CN)6]4—中不存在__________________。
A.共价键 B.非极性键 C.配位键 D.σ键 E.π键
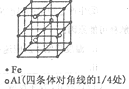
(3)一种Al-Fe合金的立体晶胞如右图所示。请据此回答下列问题:
①确定该合金的化学式__________________。
②若晶体的密度=ρg/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为______cm。
【答案】 能量最低原理 s sp杂化 直线形 8 ![]() B Fe2Al
B Fe2Al 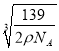
【解析】(1)①由图1电子轨道排布图可知,3s能级未填满就填充3p能级,2p能级的轨道内有自旋方向相同的2个电子,所以违背能量最低原理。由表中电离能可知,二者第三电离能剧增,故为+2价,都为短周期元素,故A为铍、B为Mg,镁价层电子排布为3s2,处于周期表中S区,故答案为:能量最低原理;S。
②BeCl2分子中Be的成2个σ键,杂化轨道数为2,采取sp杂化,没有孤对电子对,为直线型,故答案为:SP;直线型。
(2)①从图中可以看出,这是体心立方堆积,属于钾、钠和铁型,其原子的配位数为8,②CN-中C原子与1个单位负电荷用N原子替换可得CN-等电子体的单质为N2,其电子式:![]() 。
。
③六氰合 亚铁离子[Fe(CN)6]4-中Fe2+与CN-形成配位键,CN-中存在C≡N三键,为极性共价键,三键中有1个σ键2个π键,所以CN-中共价键、配位键、σ键、π键;故答案为:B;N2;
(3)①由晶胞图2,晶胞中含有4个Al原子,且都位于晶胞内部,则晶胞平均含有4个Al,晶胞中Fe位于顶点的有8个,位于面心的有6个,位于棱上的有12个,位于体心的有1个,含有Fe原子数目为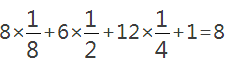 ,Fe与 Al原子数目之比为8:4=2:1,故该合金的化学式为Fe2Al,故答案为:Fe2Al;
,Fe与 Al原子数目之比为8:4=2:1,故该合金的化学式为Fe2Al,故答案为:Fe2Al;
②一个晶胞中含有8个Fe原子和4个Al原子,晶胞的质量为![]() ,
,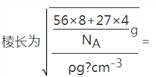
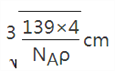 =
=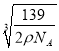 。
。


科目:高中化学 来源: 题型:
【题目】用如图装置(X、Y是直流电源的两极)分别进行下列各组实验,则下表中所列各项对应关系均正确的一组是( )
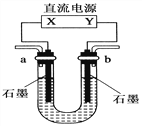
选项 | 电源 X极 | 实验前U形管中液体 | 通电后现象及结论 |
A | 正极 | Na2SO4溶液 | U形管两端滴入酚酞试液后,a管中呈红色 |
B | 正极 | AgNO3溶液 | b管中电极反应式是4OH--4e-===2H2O+O2↑ |
C | 负极 | KCl和CuCl2混合溶液 | 相同条件下,a、b两管中产生的气体总体积可能相等 |
D | 负极 | Fe(OH)3胶体和导电液 | b管中液体颜色加深 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知标准状况下气体摩尔体积为22.4L/mol,但很多化学实验并非在标准状况下进行,而是在常温常压下进行,下图为测定常温常压下气体摩尔体积的实验装置图。图中反应原理为:2C2H5OH+2Na→2C2H5ONa+H2↑(反应放热)。

(1)①该装置有明显错误处,请指出错误之处:_________;
②作图修改(只针对需修改部位):_____________。
(2)经过(1)改正后进行实验,实验过程如下:
a.检查装置气密性;
b.常温常压下,取4.6g乙醇与足量的金属钠反应并利用排水法收集产生的H2(假设广口瓶和量筒足够大);
c.当圆底烧瓶中不再有气泡产生,不能立即读数,必须先_____,后________,再平视读取量筒中收集到水的体积为1240.0mL。经计算常温常压下气体摩尔体积为__________。
(3)经过(1)改正后仍有实验误差,下列哪些选项会导致实验误差_______。
A.收集到的氢气中含有装置中原有的空气
B.收集H2前导管B中无蒸馏水
C.分液漏斗中的无水乙醇进入圆底烧瓶后占用了装置内气体空间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.4mol·L-1—元酸HA与0.2mol·L-1NaOH溶液等体积混合后,所得溶液pH>7,溶液部分微粒组分及浓度如下图所示。下列说法正确的是

A. HA是弱酸
B. 图中未表示出的微粒的浓度小于0.lmol/L
C. 该混合溶液中:c(HA)+c (X)=c(Na+)
D. 图中M表示HA,Y表示OH-,Z表示H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去 括号内的杂质,所选用的试剂或方法不正确的是
A.Na2CO3溶液(NaHCO3),选用适量NaOH溶液
B.NaHCO3溶液(Na2CO3),通入过量的CO2气体
C.Na2O2粉末(Na2O),将混合物在氧气中加热
D.CO2气体(CO),通入O2点燃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸亚铁(FeCO3)是一种重要的工业盐。某学习小组对用FeSO4制备FeCO3
资料显示:FeCO3:白色结晶,难溶于水;干燥品在空气中稳定,湿品暴露在空气中缓慢氧化生成红棕色的水合氧化铁FeO(OH。
(1)实验探究Ⅰ
实 验 Ⅰ | 操作 | 现象 |
| 1、混合后出现白色絮状沉淀,振荡,部分沉淀呈灰绿色,无气泡产生 2、放置5-8分钟,灰绿色沉淀逐渐增多,最终变成红褐色 |
①生成FeCO3离子方程式:_________________________________。
②反应过程中可能生成Fe(OH)2的依据是__________________________________。
③取沉淀离心、充分洗涤,加足量稀硫酸,沉淀溶解且有气泡产生,证明白色沉淀中含有CO32-;此时溶液中存在的金属阳离子有__________________________________。
(2)实验探究Ⅱ
实验Ⅱ | 操作 | 现象 |
| 1、混合后,试管中出现白色颗粒状浑浊,片刻后有大量气泡产生 2、振荡,粘附在试管内壁的白色颗粒状浑浊变红棕色,且越来越多;20分钟后,白色浑浊明显沉降 |
①经检验,试管中白色颗粒状浑浊是FeCO3,请结合化学用语从平衡角度解释产生大量气泡的原因______________________________________________。
②分析现象认为:实验Ⅱ所得固体中FeCO3的含量比实验Ⅰ多。支持该结论的操作及现象如下:分别两种沉淀离心过滤、洗涤、干燥后称取等质量的两种固体,___________________则结论成立。
(3)实验探究Ⅲ
实验Ⅱ | 操作 | 现象 |
| 1、混合后,试管中出现白色颗粒状浑浊,片刻后有大量气泡产生 2、一段时间后将带有气球(排尽空气)的胶塞塞紧试管,振荡后放置5小时,气球膨胀,试管中沉淀物始终保持白色 |
实验改进的意图是____________。
(4)综合以上实验,下列说法正确的是__________
a.用NaHCO3制得FeCO3纯度高的原因之一是因为NaHCO3溶液碱性弱
b.用1 L 1.0 mol/L NaHCO3与足量FeSO4溶液反应理论上可制备116 g FeCO3
c.湿品FeCO3在空气中缓慢氧化的方程式为 4FeCO3+O2+6H2O=4Fe(OH)3+4CO2
d.工业上用NH4HCO3和FeSO4反应可制备纯度更高的FeCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A和a是生活中常见的两种有机物,可用于制备安眠药苯巴比妥Q,合成过程如下:
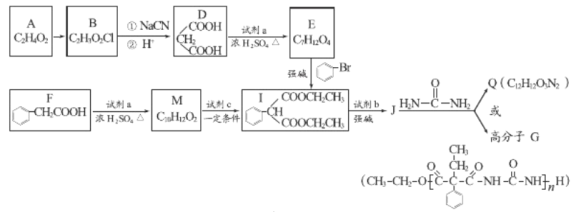
已知: 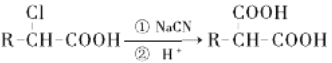
(1)A的官能团名称为_________。
(2)A→B的反应类型为_________。
(3)D→E的反应方程式为_________________________。
(4)写出F符合下列条件的同分异构体的结构简式_________。
①遇Fe3+溶液显紫色 ②发生银镜反应 ③苯环上的一溴代物有两种
(5)J与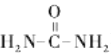 在催化剂作用下既可以生成Q,又可以生成G,写出生成G的化学方程式 _________________________________。
在催化剂作用下既可以生成Q,又可以生成G,写出生成G的化学方程式 _________________________________。
(6)下列说法正确的是 _________。
a.E与M互为同系物
b.B水解酸化后的产物可以发生加聚反应
c.用试剂b制备乙烯的条件是NaOH的醇溶液、加热
d.Q的结构简式是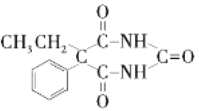
(7)试剂c为酯类,核磁共振氢谱有两组吸收峰,与M反应生成I和a,此反应为取代,则试剂c的结构简式为 _________。
(8)写出以CH2=CH-CH=CH2和E为主要原料制备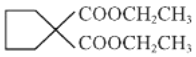 的流程_____________________________________________________________。
的流程_____________________________________________________________。
(无机试剂自选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是
A. K值不变,平衡可能移动 B. K值变化,平衡一定移动
C. 平衡移动,K值可能不变 D. 平衡移动,K值一定变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,Ksp[Mg(OH)2] =5.61×l0-12,Ksp[Al(OH)3] =1.3×l0-33,Al(OH)3![]() AlO2-+H++H2O Ka=6.31×l0-13。某溶液中可能含有 H+、Na+、Mg2+、Al3+、Cl-、HCO3-等离子。向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示。下列有关说法正确的是
AlO2-+H++H2O Ka=6.31×l0-13。某溶液中可能含有 H+、Na+、Mg2+、Al3+、Cl-、HCO3-等离子。向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示。下列有关说法正确的是

A. b 点沉淀—Al(OH)3;d 点沉淀—A1(OH)3和Mg(OH)2;e点溶质—NaA1O2
B. 依据题意,用NaOH不能完全分离Mg2+和Al3+离子
C. cd 段发生的反应为:Mg2+ +2OH- =Mg(OH)2↓
D. bc 段发生的反应为:Al(OH)3+OH-=A1O2-+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com